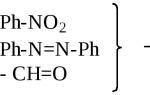Raua 3 redutseerimine rauaks 2. Raua otsese redutseerimise protsessid
Töö tekst on paigutatud ilma kujutiste ja valemiteta.
Töö täisversioon on PDF-vormingus saadaval vahekaardil "Tööfailid".
1. Sissejuhatus
Katalüüs on looduses levinud (enamik elusorganismides toimuvatest protsessidest on katalüütilised) ja seda kasutatakse laialdaselt tehnoloogias (enamik tööstuslikke reaktsioone on katalüütilised). Seetõttu otsustasime seda nähtust üksikasjalikumalt uurida.
Õppeobjekt: katalüüs
Õppeaine: tingimused, mis mõjutavad katalüüsiprotsessi kulgu
Hüpotees: kui selgub katalüüsi kulgemise sõltuvus erinevatest teguritest ja luuakse sobivad tingimused, siis on katalüüsi praktiline rakendamine tõhus
Sihtmärk: paljastada katalüüsi käigu sõltuvus erinevatest teguritest, mis määravad selle praktilise rakendamise
Ülesanded:
1) Uurida keemia katalüüsi teooria kujunemislugu
2) Uurige katalüüsi tüüpe
3) Uurida katalüütiliste reaktsioonide toimumise tingimusi
4) Katseliselt tõestada katalüsaatorite ja reaktsioonitingimuste mõju nende kiirusele, mis määrab nende praktilise kasutamise
2. Põhikorpus
Katalüüs - keemilise reaktsiooni kiiruse muutumine kokkupuutel ainetega (katalüsaatorid või inhibiitorid), mis osalevad reaktsioonis, kuid ei ole toodete koostises.
Katalüsaatorid - keemiliste reaktsioonide kiirust suurendavad ained, mille koostis ja kogus reaktsiooni lõppedes jääb muutumatuks.
Inhibiitorid keemiliste reaktsioonide kiirust aeglustavad ained, mille koostis ja kogus reaktsiooni lõppedes jäävad muutumatuks.
2.1. Keemia katalüüsi teooria kujunemisloo uurimine
Sõna "katalüüs" võttis tõenäoliselt esmakordselt kasutusele 16. sajandil keemik A. Libavius oma õpikus "Alkeemia" ja see tähendas "lagunemist" või "hävitamist". 1835. aastal legaliseeris selle termini I. Berzelius reaktsioonide jaoks, mis toimuvad võõrühendite juuresolekul, mis ise ei näi reaktsioonis osalevat. Täpsemalt kirjutas Berzelius katalüütilisest jõust, mis viib kehade lagunemiseni.
Tegelikult isegi "mittebioloogilised", s.t. mitteensümaatilist katalüüsi tunti ammu enne Libaviust ja veelgi enam Berzeliust. Esimene meile tuntud mittebioloogilise katalüütilise protsessi näide on dietüüleetri süntees alkoholist väävelhappe osalusel (8. sajand, Jabir ibn Khayyam). Teist korda avastas selle reaktsiooni 1540. aastal Valeri Kordus ja see sai tehnoloogilise vormistuse S. Frobeniuse töödes.
17. ja 18. sajandil avastati keemia teaduslike aluste loomise ajal mitmeid katalüütilisi reaktsioone, mis hõlmasid mittebioloogilisi katalüsaatoreid. Nii töötasid A. Lefebvre ja N. Lemery 1666. aastal välja väävelhappe sünteesi kambermeetodi, mis põhines varasematel arengutel. See on 17. sajand. Ja alles järgmise, 18. sajandi lõpus, uurisid väävelhappe sünteesi mehhanismi M. Clement ja H. Desormes.
18-19 sajandit iseloomustab üldiselt tööstuse kiire areng, kuid keemiatööstus on alles tekkimas, mineraalhapete järele on nõudlus suurtes kogustes, ennekõike seetõttu tekivad katalüütilised protsessid H 2 SO 4 tootmiseks. , seejärel HNO 3 tootmise protsessid.
19. sajandi lõpp - 20. sajandi algus - põllumajanduse areng - mineraalväetiste vajadus. Ilmub Haberi ammoniaagi sünteesi protsess ja ammoniaagi oksüdatsiooni protsess, st lämmastikhappe süntees.
20. sajandi 30-40ndad:
Saksamaa, kes arendab aktiivselt sõjatööstust ja vajab sõjavarustuse jaoks kütust, on ära lõigatud süsivesinike tooraine allikatest. Selline olukord kutsub esile töö kiire tõusu sünteetilise kütuse saamiseks alternatiivsetest tooraineallikatest. Need on Fischer-Tropschi ja Reppe tööd.
Ja lõpuks, 1950-60ndatel - naftakeemia ja polümeeride keemia kiire arengu alguses - loovad Ziegler ja Natta olefiinide polümerisatsiooni katalüsaatorid, ilmuvad protsessid hapnikku sisaldavate toodete saamiseks olefiinide oksüdeerimisel.
2.2. Katalüüsi tüüpide uurimine
Vastavalt mõjule reaktsiooni katalüüsi kiirusele jagunevad paljud allikad positiivne (reaktsiooni kiirus suureneb) ja negatiivne (reaktsioonikiirus aeglustub). Viimasel juhul toimub inhibeerimisprotsess, mida ei saa pidada "negatiivseks katalüüsiks", kuna inhibiitor kulub reaktsiooni käigus ära.
Katalüüs toimub homogeenne Ja heterogeenne (kontakt). Homogeense katalüüsi korral on katalüsaator reaktiividega samas faasis, heterogeensed katalüsaatorid erinevad faasi poolest (lisa 1).
Tasub eraldi mainida mikroheterogeenne katalüüs, mille käigus katalüsaator on kolloidses või makromolekulaarses olekus. Seda tüüpi katalüüsi näited on biokatalüütiline protsessid, milles ensüümid on katalüsaatorid, mis kiirendavad paljusid eluprotsesside kulgemiseks hädavajalikke keemilisi reaktsioone.
Vahepealse interaktsiooni olemuse järgi eristatakse kahte katalüütiliste reaktsioonide rühma - happe-aluse Ja redoks-katalüüs.
Esimese rühma reaktsioonides toimub reagentide vahepealne happe-aluse interaktsioon katalüsaatoriga, st prootoni ülekandmine katalüsaatorilt ühele reagendile või vastupidi, reagendilt katalüsaatorile. Katalüütilise reaktsiooni järgmistes etappides liigub prooton vastupidises suunas ja katalüsaator taastab oma koostise. Happe-aluse katalüüsi näited on: hapetega kiirendatud estrite hüdrolüüs, olefiinide hüdratsioon fosforhappe katalüsaatorite juuresolekul, isomerisatsioon, süsivesinike krakkimine alumiiniumsilikaatkatalüsaatoritel ja paljud teised reaktsioonid.
Redoks-katalüüsi reaktsioonides on vahepealne interaktsioon seotud elektrooniliste üleminekutega katalüsaatori ja reaktiivide vahel. Sellesse katalüütiliste reaktsioonide rühma kuuluvad vääveldioksiidi oksüdeerimine trioksiidiks väävelhappe tootmisel, ammoniaagi oksüdeerimine lämmastikoksiidiks lämmastikhappe tootmisel, arvukad orgaaniliste ühendite, nagu etüleen etüleenoksiidiks, osalise oksüdeerimise reaktsioonid, naftaleen ftaalanhüdriidiks, hüdrogeenimine, dehüdrogeenimine, süsivesinike tsüklistamine ja aromatiseerimine, vesinikperoksiidi lagunemine, metalliioonide redutseerimine ja oksüdeerimine lahustes ning paljud teised reaktsioonid.
Selgituseks katalüütiliste reaktsioonide mehhanism pakuti välja kolm teooriate rühma: geomeetriline, elektrooniline ja keemiline. IN geomeetriline Teooriad keskenduvad katalüsaatori aktiivsete tsentrite aatomite geomeetrilise konfiguratsiooni ja katalüsaatoriga seondumise eest vastutava reageerivate molekulide osa aatomite vahelisele vastavusele. Elektrooniline teooriad põhinevad ideel, et kemisorptsioon on tingitud laenguülekandega seotud elektroonilisest interaktsioonist, need teooriad seostavad katalüütilist aktiivsust katalüsaatori elektrooniliste omadustega. Keemiline Teooria käsitleb katalüsaatorit kui iseloomulike omadustega keemilist ühendit, mis moodustab reagentidega keemilised sidemed, mille tulemusena moodustub ebastabiilne üleminekukompleks. Pärast kompleksi lagunemist koos toodete vabanemisega naaseb katalüsaator algsesse olekusse. Viimast teooriat peetakse praegu kõige adekvaatsemaks.
2.3. Katalüütiliste reaktsioonide toimumise tingimuste uurimine
Katalüsaatorid muudavad keemilise reaktsiooni kiirust, muutes selle mehhanismi. Oletame, et aine A ja aine B vahel on võimalik koostoime aine AB moodustumisega: A + B → A ... B → AB
Selle reaktsiooni aktiveerimisenergia on suur - seetõttu kulgeb reaktsioon väga madala, praktiliselt nulliga võrdse kiirusega. Oletame, et on olemas aine K (katalüsaator), mis kergesti interakteerudes ainega A moodustab ühendi AK: A + K → A ... K → AK
See reaktsioon on kiire, kuna selle aktiveerimisenergia on madal. AK ühend interakteerub samal põhjusel kergesti ainega B, moodustades ained AB ja K: B + AK → B ... A ... K → AB + K. Reaktsiooni energiaskeem on toodud lisas 2 .
Viimased kaks võrrandit kokku võttes saame:
B + AK = AB + K
Seega aine K osales protsessis, kuid jäi selle tulemusena keemiliselt muutumatuks. Katalüsaatori puudumisel kulges reaktsioon ainete A ja B otsese interaktsiooniga väga aeglaselt. Katalüütiline reaktsioon toimub kahes etapis: vaheühendi AK moodustumise kaudu - väga kiiresti.
3. Eksperimentaalne osa
Katalüüsi fenomeni praktiliseks uurimiseks viisime läbi rea katseid, mille fotod on toodud 3. lisas.
Katse nr 1 katalüüsi protsess. Reaktsioon viidi läbi tõmbekapis. Segasime uhmris jahvatatud 1 g alumiiniumipulbrit ja 4 g joodi. Seejärel valati koonusekujulise hunnikuna välja. Reaktsiooni märke ei olnud, seega lisasime paar tilka vett. Tasapisi hakkas paistma paks lillakas suits (foto1). Selles reaktsioonis toimib vesi katalüsaatorina.
Katse nr 2 Homogeense katalüüsi näide. Vesinikperoksiidi lagunemisreaktsiooni viisime läbi tetraamiin-vask(II)sulfaadi SO 4 lahuse juuresolekul. Katalüsaatori valmistasime eelnevalt ette, segades vask(II)sulfaati ammoniaagilahusega.
Cu SO 4 + 4NH3 ∙ H 2 O \u003d SO 4 + 4H 2 O
SO4
2H 2O 2 \u003d 2H 2O + O 2
Katse nr 3 Heterogeense katalüüsi näide. Ammoniaaki oksüdeerisime õhuhapnikuga kroom(III)oksiidi juuresolekul, mis tekib ammooniumdikromaadi lagunemisel:
(NH 4) 2 Cr 2 O 7 \u003d Cr 2 O 3 + N 2 + 4H 2 O
Ammoniaagilahus asetati 500 ml mahuga keemilisse kolbi ja suleti korgiga. Ammooniumdikromaat kuumutati piirituslambil ja asetati seejärel ammoniaagiga kolbi. Ammooniumdikromaadi osakesed sädelesid nende ümber põlevast ammoniaagist. Seda kogemust nimetatakse "tähevihmaks" (foto 3).
4NH3 + 5O 2 \u003d 4NO + 6H 2 O
Katse nr 4 Positiivne ja negatiivne katalüsaator. aga) Keemilisse keeduklaasi 3 ml veega lisasime 1 tilk kaaliumtiotsüanaadi ja raud(III)kloriidi lahuseid. Tekkis punane lahus, mis valati võrdselt kahte katseklaasi. Kahes teises katseklaasis kummaski 2 ml naatriumtiosulfaati ja ühte neist lisati mõni tilk vasksulfaadi (II) katalüsaatori lahust. Naatriumtiosulfaadi lahus lisati raud(III)tiosulfaadi lahusele. Lahus muutus kollaseks. Teise katseklaasi lisati raudtiotsüanaadiga naatriumtiosulfaat koos vasksulfaadiga. Lahus muutus samuti kollaseks, kuid siin kukkus välja sade (foto 4).
FeCl3 + 3KCNS = Fe(CNS)3 + 3KCl
2Fe(SCN)3 + 2Na 2S2O3 = Na2S4O6 + 2Fe (SCN)2 + 2NaSCN
b) Valasime 2 ml vask(II)sulfaadi lahust kahte katseklaasi ja asetasime mõlemasse katsutisse alumiiniumgraanuli. Ühte katseklaasi lisati mõned katalüsaatori, lauasoola, kristallid. Katalüsaatoriga katseklaasis kaeti graanul kiiresti vasega, teine aga jäi muutumatuks. Naatriumkloriid kiirendab protsessi (foto 5).
2Al + 3CuSO 4 \u003d Al 2 (SO 4) 3 + 3 Cu
c) Vesinikperoksiidi lagunemine boorhappe juuresolekul. Protsess oli aeglane, kuna boorhape H 3 BO 3 toimib inhibiitorina (foto 6).
Katse nr 5 Bioloogilised katalüsaatorid – ensüümid. aga) Kahte klaasi valati vesinikperoksiid, esimesse klaasi pandi tükk keedetud kartulit, teise kartulimahla. Esimeses klaasis ei juhtunud midagi ja teises hakkas peroksiid kohe lagunema.
2H 2O 2 \u003d 2H 2O + O 2
b) Kahte klaasi valati vesinikperoksiid, esimesse klaasi pandi tükk keedetud porgandit, teise porgandimahla. Tulemused on kooskõlas eelmistega (foto 7).
Vesinikperoksiid on mürgine aine, mis tekib rakus elu jooksul. Osaledes mitmete toksiliste ainete neutraliseerimises, võib see põhjustada enesemürgitust (valkude, eriti ensüümide denatureerimine). H 2 O 2 kogunemist takistab ensüüm katalaas, mis on levinud rakkudes, mis võivad eksisteerida hapnikuatmosfääris. Ensüüm katalaas, mis lõhustab H 2 O 2 veeks ja hapnikuks, mängib rakus kaitsvat rolli. Ensüüm toimib väga suure kiirusega, üks selle molekul lõhustab 1 sekundiga 200 000 molekuli.
Katse nr 6 Erinevate katalüsaatorite aktiivsuse kvalitatiivne määramine. Katalüsaatoriteks olid plii(II)oksiid ja mangaan(IV)oksiid. Lisasime kahte katseklaasi 10 tilka 3% vesinikperoksiidi lahust. Ühte katseklaasi lisati veidi pliioksiidi ja teise sama palju mangaanoksiidi ning mõlemas märgiti üles täieliku lagunemise aeg. Mangaanoksiidiga katseklaasis lõppes lagunemine 55 sekundiga ja pliioksiidiga katseklaasis 7 minutiga. Sellest järeldub, et mangaanoksiid on aktiivsem kui pliioksiid.
Katse nr 7. Katalüsaatori koguse mõju uurimine vesinikperoksiidi lagunemiskiirusele. Mõõtesilindrit kasutades valasime kahte katseklaasi 5 ml 3% vesinikperoksiidi lahust. Ühte katseklaasi lisati spaatli otsas mangaan(IV)oksiidi pulbrit, teise kaks korda rohkem. Esimeses torus lõppes lagunemine 2 minuti 46 sekundiga ja teises torus 1 min 35 sekundiga. Seega, mida rohkem katalüsaatorit, seda kiirem on reaktsioon.
Katse nr 8 Autokatalüüs. Uurisime autokatalüüsi nähtust kaaliumpermanganaadi ja oksaalhappe interaktsiooni näitel, lähtudes võrrandist:
5H2C2O4 + 2KMnO4 + 3H2SO4 = 10CO2 + 2MnSO4 + K2SO4 + 8H2O
Katseklaasi lisati üks tilk kaaliumpermanganaadi lahust, lisati destilleeritud vee lahusele sellises koguses, et saadi läbipaistev roosa lahus. 10 tilka saadud lahust, 2 tilka oblikhapet ja 4 tilka väävelhappe lahust valati kuiva katseklaasi. Raputage katseklaasi. Lahus muutus värvituks 38 sekundiga. Pärast ühe mangaan(II)sulfaadi kristalli lisamist segule valati sama asi teise katseklaasi. Lahus muutus koheselt värvituks. Esimesel juhul kiireneb reaktsioon järk-järgult katalüsaatoriks olevate mangaaniioonide hulga suurenemise tõttu. Teisel juhul kulgeb reaktsioon kiiresti, sest mangaaniioonid olid lahuses juba algusest peale.
4. Järeldus
Katalüsaatorite kasutamine aitas kaasa keemiatööstuse kiirele arengule. Neid kasutatakse laialdaselt nafta rafineerimisel, erinevate toodete hankimisel, uute materjalide (näiteks plastide) loomisel, mis on sageli odavamad kui varem kasutatud. Ligikaudu 90% tänapäevasest keemiatoodangust põhineb katalüütilistel protsessidel. Katalüütilised protsessid mängivad keskkonnakaitses erilist rolli.
1) Katalüüs võimaldab normaalsetes tingimustes läbi viia reaktsioone, mis nõuavad suuri energiakoguseid.
2) Katalüüs on meie elu lahutamatu osa. Ta osaleb paljudes protsessides.
Pärast uurimistööd sain teada, mis on katalüüsiprotsessi olemus, selgus selle nähtuse kulgemise sõltuvus erinevatest teguritest, mis määravad selle praktilise rakendamise.
Seega leiab mu uurimistöö hüpotees kinnitust.
5. Viited
1. Afanasjev V.A., Zaikov G.E. Katalüüsi maailmas. M.: Nauka, 1977. - 107 lk.
2. Akhmetov N. S. Anorgaaniline keemia. Proc. ülikoolide jaoks. - 4. väljaanne, Rev. - M.: Kõrgkool, 2001. - 743 lk.
3. Balaev I.I. Kodune eksperiment keemias. M.: Valgustus, 1977
4. Zbarsky B.I., Ivanov I.I., Mardašev S.R. Bioloogiline keemia. L.: Meditsiin. Linane. osakond, 1972
5. Lühikeemiline entsüklopeedia v. 1-5. Ed. I.L. Knunyants, M.: "Nõukogude entsüklopeedia", 1981-1987.
6. Nikolaev L.A. Elu keemia. M.: Valgustus, 1973
7. Olgin O.M. Katsed ilma plahvatusteta. Moskva: keemia, 1986
Interneti saidid:
http://www.hemi.nsu.ru/ucheb216.htm
http://www.himhelp.ru/section23/section5/section33ytrg/
http://www.xumuk.ru/encyklopedia/1913.html
6. Rakendused
Lisa 1. Katalüüsi klassifikatsioon
Lisa 2. Katalüütilise protsessi energiaskeem
Lisa 3. Fotod katsetest
Rauamaagi materjalide rauasisalduse suurendamise viise nimetatakse protsessideks metalliseerimine. Saadud toodet nimetatakse metalliseeritud. Under metallistamise aste viitab tavaliselt raua protsendile tootes.
Eesmärgi järgi jagatakse metalliseeritud tooted tavaliselt kolme rühma, olenevalt metallistamise astmest:
1) kõrgahjussulatuse laenguna kasutatakse kuni 85% Fe-produkti;
2) 85-95% Fe - toodet kasutatakse terase valmistamisel laenguna;
3) >98% Fe - toodet kasutatakse rauapulbri tootmiseks.
Rauamaagi materjalide metalliseerimise protsessid viiakse läbi temperatuuril mitte üle 1000–1200 °C, st tingimustes, kus nii tooraine (rauamaak või rauamaagi kontsentraat) kui ka toode on tahkes faasis ning pehmenemist ei toimu. materjalidest, nende kleepumist ja kleepumist täitematerjalide seintele. Selliseid protsesse raua otseseks tootmiseks maakidest nimetatakse tahkis taastamise protsessid(PTV). Kuna saadud materjal meenutab poorset käsna, nimetatakse seda sageli "käsnarauaks". Välismaal aktsepteeritakse lühendit DRI (inglise keelest Direct-Reduced-Iron) või DI (Direct-Iron). Suurem osa saadud toodetest kasutatakse terasetootmisüksuste laenguna.
Raudoksiidide redutseerimiseks kasutatakse tavaliselt redutseerijana kivisütt (tahke redutseerija) või maagaasi (gaasiline redutseerija). Sel juhul on eelistatav kasutada mitte "toorest" maagaasi, vaid kuumi redutseerivaid gaase, kuna sel juhul ei kulutata süsivesinike dissotsiatsioonile soojust ja soojuse sisend määratakse redutseerivate gaaside kuumutamise teel.
Redutseerivad gaasid saadakse gaasiliste süsivesinike muundamisel 1 või tahkekütuste gaasistamisel. Maagaasi muundamine võib olla:
hapnik (õhk)
CH4 + 1/2O2 = CO + 2H2+ K,
CH 4 + H 2 0 \u003d CO + ZH 2 - K,
süsinikdioksiid
CH 4 + CO 2 \u003d 2CO + 2H 2 - K,
Auru ja süsinikdioksiidi reformimise korral on reaktsiooni kulgemiseks vaja soojust. Muundamine viiakse läbi spetsiaalses aparaadis, kasutades katalüsaatoreid.
Tahke kütuse gaasistamine toimub vastavalt järgmistele reaktsioonidele:
C + 1/2O 2 = CO + K,
C + H 2 O \u003d CO + H 2 - K,
C + C0 2 \u003d 2CO - K,
Praegu töötab maailmas palju otsereduktsiooni tehaseid, peamiselt odava toorainega riikides (India, Mehhiko, Venezuela, Lõuna-Aafrika Vabariik).
WFP protsesse ja installatsioone on mitut tüüpi (joonis 7.1). Levinumad meetodid on Midrex (MIDREX, USA) ja HyL (HyL, firma nimega Hojalata-y-Lamina, Mehhiko). Ligikaudu 2/3 kogu maailma otsese raua toodangust toodetakse Midrexi meetodil, ligikaudu ¼ ChiL-meetodil
1 Alates lat. konversioon- muutumine, teisenemine
Riis. 7.1.Ühikute skemaatilised diagrammid
aastal kasutatud otsest vähendamist
protsessid:
a-Midrex (MIDREX); 6-HIL(hyL); e-Krup-pa (Krypp-Rennverfahren). Nimetused: O-rauamaagi pelletid; R - maak; GJ- käsnraud; VG- redutseeriv gaas; ALATES- heitgaasid; T- kütus; U- kivisüsi
Midrexi protsessi (joon. 7.2) peamine erinevus seisneb maagaasi muundamise meetodis, mis selles protsessis viiakse läbi ahju heitgaasis sisalduva süsinikdioksiidi abil vastavalt reaktsioonile CH 4 + CO 2 = 2CO + 2H 2. Enne heitgaasi konversioonitehasesse tarnimist puhastatakse see tolmust ja H 2 O-st. Konverteeritud gaas, mis sisaldab -35% CO ja ~65% H 2, juhitakse ahju temperatuuril 750 "C. Lisaks , jahutatud ringgaas juhitakse ahju gaasi alumisse ossa Jahutatud pelletid sisaldavad ~95% Fe ja ~1% C. Käsna süsinikusisaldust saab vajadusel suurendada.
Metalliseeritud jahutatud graanulid laaditakse pidevalt maha 5 tuhande tonnise mahutavusega punkrisse, kus neid hoitakse kuni kaarahjudes sulatamiseni inertses atmosfääris. Protsessi maagaasi kulu on umbes 350 m 3 1 tonni toote kohta. See protsess viidi läbi meie Oskoli elektrometallurgiatehases.
Riis. 7.2. MIDREXi protsessi skemaatiline diagramm:
1 -puhur; 2 - soojusvaheti; 3 - gaasisegisti; -/-teisendusüksus-kompressor; 6 - skraber ülemise gaasi jaoks; 7 šahtiahi; 8- pesumasin- 9- vibreeriv ekraan; 10- briketipress
Perioodiliselt töötavate HyL-retortide (HyL) redutseerimisprotsessi põhijooneks on maagaasi aurureformimise kasutamine, mis viiakse läbi seadmetes, milles paikneb telliskivist pakend, millele on lisatud katalüsaatorina niklit. Muundamine toimub reaktsiooniga CH 4 + H 2 0 = CO + 3H 2.
Gaas väävlitustatakse enne muundamist. Saadud muundatud gaas sisaldab umbes 14% CO, 58% H2, 21% H20 ja 4-5% CO2. Kuum gaas läbib heitsoojuskatla ja eraldub veeaurust. Kuiv muundatud gaas sisaldab umbes 73% H 2 , 15-16% CO ja 6-7% CO 2 . Seda kuumutatakse torukujulistes soojusvahetites temperatuurini 980–1240 ºС, soojendades seda regenereerimisseadmetest väljuva gaasiga. Nendes üksustes kuumutatakse graanuleid või maake redutseeriva gaasi füüsilise soojuse kasutamise tulemusena ning temperatuuril 870–1050 ° C redutseeritakse raud vesiniku ja süsinikmonooksiidiga. Esimestel paigaldustel kasutati retorte redutseerimisüksustena. Selliseid repliike on rajatises neli.
Retorti seade on näidatud joonisel fig. 7.3. Retortide ümberpaigutamine ühest positsioonist teise tagab protsessi tsüklilisuse, mis koosneb järjestikustest
Riis. 7.3. Retort metalliseerimiseks vastavalt HyL-meetodile:
1 - hüdrosilinder; 2 - käru; 3 - sõita; 4 - kest; 5- kate; 6- laadimiskael; 7-platvorm hoolduseks; 8- kangidega lõikur käsna eemaldamiseks; 9- vooder; 10- klapi juhtimismehhanism; 11 - kokkupandav põhi; 12- tühjendusrenn
rauamaagi laadimise, soojendamise ja vähendamise, käsnraua jahutamise ja mahalaadimise toimingud. Pärast laengu laadimist retortidesse juhitakse neisse ülevalt gaas. Valmis käsna mahalaadimiseks kasutatakse lõikurit ja spetsiaalseid mahalaadimiskaabitsaid. Käsnaraud siseneb renni ja seejärel kogumiskonveierile, mis transpordib käsna terasepoodi. Igas tehases osaleb gaasiringis neli retorti, milles toimuvad järgmised protsessid: ühe laadimisega eelsoojendus ja selle vähendamine gaasiga, mis väljub teistest retortidest, kuivatatakse (ilma H 2 O) ja kuumutatakse; kahel juhul lisaraua täiendav vähendamine konversioonitehases toodetud kuumutatud gaasiga; viimases - karburiseerimine.
Raua redutseerimisaste valmistootes on 75-92%. 1 tonni toote kohta (käsnraud) kulub 600 m 3 maagaasi ja ca 36 MJ elektrit.
Muid käsnraua tootmise meetodeid ei kasutata laialdaselt. Tähelepanu väärivad vaid tehnoloogiad, mis tagavad keeruliste maakide koksivaba töötlemise, mis sisaldavad lisaks rauale ka selliseid väärtuslikke komponente nagu vanaadium, titaan, nikkel jm.reivitakse taimi, kasutades tahke redutseerijana mis tahes mittekoksisütt.
Tehnoloogiline skeem on järgmine: 1) rauamaagi materjali granuleerimine tahke kütusega söemaagi graanulite saamiseks; 2) graanulite röstimine rest-tüüpi seadmetes kõrge metalliseeritud tooraine saamiseks; 3) metalliseeritud graanulite kasutamine legeeriva lisandina terase tootmisel elektriahjudes.
Peamine kogus, mis saadakse otsese vähendamise meetoditega metalliseeritud toode kasutatakse laadimismaterjalina. Sellel tootel on palju erinevusi tavaliselt kasutatavast laengust (metallijäägid ja malm).
1. Metalliseeritud toode, mis saadakse puhtast laengust, praktiliselt ei sisalda tavalisele metallijäätmetele iseloomulikke lisandeid (Cr, Ni, Cu, Sn jne). Selle toote nii väärtuslik kvaliteet muudab selle asendamatuks tooraineks väga puhta terase saamiseks kriitilistel eesmärkidel.
2. Kui toode sisaldab 92–95% Fe, sisaldab see 5–8% raudoksiidi (tavaliselt ränidioksiidi ja mõningaid redutseerimata raudoksiide). Järgneva sulatamise käigus läheb aheraine räbuks, suurendades selle kogust ja sulatamiseks kuluvat soojust. Lisaks on räbu sisaldava ränidioksiidi räbu jaoks vaja täiendavat lubja tarbimist, mis suurendab räbu massi veelgi.
3. Otsese redutseerimise meetoditega saadud toode on väikese tihedusega, mistõttu paljudes tehastes briketeeritakse kuummetalliseeritud toode, et suurendada selle puistetihedust, kasutada metalliseeritud peenosakesi ja suurendada seadmete vastupidavust. sekundaarse oksüdatsiooni vastane toode (passiveerida toode).
Mõned metalliseeritud toote omadused on toodud tabelis. 7.1.
Tabel 7.1. Metalliseeritud toote omadused
4. Otsese redutseerimise saadus sisaldab sageli teatud kogust süsinikku (Midrexi protsessis 1-2%). Seda tuleb arvestada sellise materjali kasutamisel madala süsinikusisaldusega teraste tootmiseks.
5. Otsene redutseerimistoode sisaldab tavaliselt mõnda (<2 %, а иногда и более) оксидов железа. При переплаве такого продукта эти оксиды должны быть восстановлены. Поскольку одновременно с оксидами железа продукт содержит углерод, то при более высоком содержании углерода в продукте допустима наиболее низкая степень металлизации и в связи с этим введено понятие ekvivalentne metallisatsiooniaste". M EQ= M f act + aga%C, kus M tõsiasi - tegelik metalliseerumisaste. Kui eeldada, et metalliseeritud tootes on oksüdeeritud raud FeO kujul, siis vastavalt reaktsioonile FeO + C = CO + Fe 1 massi kohta. Fe osakaal taastumisel kulub 6 wt. jaga C, st. a = 6 ja M ekv\u003d M fakt + 6% C. Ülemäärase süsiniku korral kulutatakse see terase karburiseerimiseks. Need kaalutlused ei võta aga arvesse seda, et raua vähenemise protsess toimub soojuse kulutamisega. Otsene redutseerimistoote kasutamine konverteri sulatamise jahutamisel näitas, et metalliseeritud toote jahutavat toimet võib aktsepteerida 1,2 korda suuremana kui tavalisel vanametallil.
6. Metalliseeritud materjali ühtlase suurusega väikesed tükid võimaldavad korraldada selle materjali kõrgelt mehhaniseeritud ja vajadusel pideva tarnimise terasetööstusüksustele.
7. Väga poorsel kõrge metalliseeritud tootel (peaaegu puhas raud) on kõrge oksüdeeritavus ja pürofoorilisus 1 .
Avatud ladustamise korral võib metallistumisaste mõne kuu või isegi nädalaga langeda 70-90%-ni. Niiskuse juuresolekul kaasneb oksüdatsiooniga soojuse eraldumine. Kui vesi satub suletud ruumi, kus pürofoorset materjali hoitakse, tõuseb temperatuur ja võib tekkida tulekahju. Samuti on vaja arvestada vesiniku eraldumise võimalusega Fe + H 2 O = FeO + H 2, seetõttu võetakse meetmeid metalliseeritud materjalide passiivistamiseks. Otsesed redutseerimistooted nõuavad oma pürofoorilisuse tõttu erilisi ettevaatusabinõusid ladustamisel ja transportimisel.
1 Kreeka keelest. ümmargune- tulekahju ja pharos- laager (peenjahvatatud olekus metallide võime õhu käes iseeneslikult süttida).
7.3. "TUUMA"METALLURGIA
Tuumareaktorite energia kasutamise võimalus metallurgilistes protsessides on väga ahvatlev. Selle idee elluviimisega on seotud mitmeid ettepanekuid ja projekte. Enamik neist kaalub võimalusi tuumareaktorite soojuse kasutamiseks tahkefaasilise redutseerimise jaoks. Samuti on tehtud ettepanekuid kasutada vee lagundamiseks aatomienergiat, millele järgneb vesiniku kasutamine raua vähendamiseks.
Meie riigis on välja töötatud tuumametallurgiakompleksi (NMC) skeem. Esialgsed arvutused on näidanud, et tuumareaktorite soojuse kasutamine otse redutseerimiseks on efektiivsem kui selle soojuse kasutamine redutseerivate gaaside saamise etapis.
NMC väljatöötatud skeem näeb ette: üksuse kõrge tootlikkuse, protsessi järjepidevuse, redutseerivate gaaside retsirkulatsiooni, kuna seadmed on paigaldatud tuumareaktorite vahetusse lähedusse. Jahutusvedelikuks valiti heelium (reaktoritehasest). Redutseerijaks valiti maagaas, mis on muundatud tuumareaktoris kuumutatud heeliumi soojuse toimel.
Skeemi kohaselt peaksid rauamaagi materjalid sisenema šahtahju, kus raua redutseerimine toimub temperatuuril umbes 850 °C. Saadud toode on ette nähtud kasutamiseks terassulatusahjude laadimismaterjalina. NMK skeemi järgi tuleb šahtahju heitgaasid puhastada H 2 O-st ja CO 2 -st ning taaskasutada.
Tulevik näitab, milline tuumaenergia kasutamise meetod metallurgias on tõhusam.
A) Raud elektrolüütide juuresolekultaastab aromaatsed nitroühendid vastavateks amiinideks (üks levinumaid tööstuslikke meetodeid). Samal ajal neli reaktsioonid :
Kiirus protsessi taastumine piirdub esimese etapiga, mis sarnaneb raua märgkorrosiooni protsessiga. Seetõttu toimub taaskasutamine keskkonnas elektrolüüt , tavaliselt, kergelt happelises keskkonnas . Koos väärtuse tõusuga keskmine pH reaktsioonikiirus väheneb. Kui pH > 12, protsess praktiliselt peatub.
elektrolüüdid süstitakse reaktsioonimassi valmis kujul (ammooniumkloriid) või saadakse reaktoris endas malmilaastude peitsimisel vesinikkloriidhappega. Enamik aktiivne elektrolüüt on ammooniumkloriid, vähem aktiivne raud(II)kloriid, ammooniumsulfaat jne.
Parim viis taastamiseks on kasutada hallid rauast laastud , mis on metallitööstuste raiskamine. Tegevus hallmalmi seletatakse galvaanilise paari elektrolüütide esinemisega liideses: raud-grafiit. Granuleeritud struktuuri tõttu laguneb hallmalm redutseerimisprotsessi käigus väikesteks osakesteks, mis põhjustab reaktsiooni kiirenemist.
Malm peab olema spetsiaalselt ette valmistatud reaktsiooni eest. Pärast purustamist ja sõelumist, samuti tolmu eemaldamist malmist laastud rasvatustatakse ja marineeritakse väikese koguse vesinikkloriidhappega, mis suurendab selle aktiivsust kloriidide moodustumise tõttu.
Taastamisprotsess malmist laastud temperatuuril reaktsioonimassi keetmine. Kütmine toimub enamasti elava auruga.
Tavaliselt laaditakse nitroprodukt järk-järgult keemistemperatuurini kuumutatud elektrolüüdi lahuses olevate malmist laastude suspensiooni. Iga järgmine portsjon manustatakse alles pärast seda, kui eelmine on reageerinud. Mõningatel juhtudel laadimise järjekord saab muuta.
Kui tulemuseks amiin lenduv auruga, osa sellest destilleeritakse auruprotsessi käigus ära. Vee- ja amiiniaurude segu kondenseeritakse külmikus, misjärel see siseneb eraldamiseks settepaaki. Ülejäänud amiin destilleeritakse välja auruga pärast taastumisprotsessi lõppu ja reaktsioonimassi leelistamist. Mõnikord sifoonitakse eelnevalt vabastatud amiin pärast reaktsioonimassi settimist redutseerijas. Amiinid, veeauruga halvasti destilleeritud, väljavõte reaktsioonimassist orgaaniliste lahustitega.
Tootmises toimub redutseerimine terasest või malmist seadmeid (käigukastid), vooderdatud diabaasplaatidega happekindlal pahtlil ning varustatud segistiga (tera või seemendiga) ja mullitajaga elava auru varustamiseks.
See meetod kasutada anestesiini, novokaiini, difenüülsulfooni ja paljude teiste ravimite tootmisel:
Meetodi eelised : tehnoloogia lihtsus, madalad toorainekulud, sihtreaktsiooniprodukti kõrge saagis. miinused : toorainebaasi vähenemine ja malmlaastude ebastabiilne kvaliteet; raskused tekkinud muda kõrvaldamisel (filtreerimine, abrasiivseid osakesi sisaldava halvasti filtreeritud raske setete transport).
B) Rauaviilud vesinikkloriid- või äädikhappes -taastama nitroühendid , asoühendid Jaaldehüüdid .

Protsess viiakse läbi keemistemperatuuril, lisades aeglaselt nitroühendi raua suspensioonile kergelt happelises vesi- või vesinikalkoholilahuses. keskkond . Alkoholi kontsentratsioon võib oluliselt mõjutada. Parimad tulemused saavutatakse sellega töötades raud redutseeritud vesinikuga. Väikese koguse lisamine nikkelkloriid kiirendab reaktsiooni.
C) raudsulfaat (II) ammoniaagi juuresolekul - taastab nitrorühm teisi redutseeritavaid rühmi sisaldavate ühendite molekulides. See meetod annab häid tulemusi aromaatsete nitrokarboksüülhapete ja nitroaldehüüdide redutseerimisel.
Katalüüs- keemilise reaktsiooni ühe võimaliku termodünaamiliselt lubatud suuna selektiivne kiirendamine katalüsaatori toimel, mis astub korduvalt vahepealsesse keemilise interaktsiooni reaktsioonis osalejatega ja taastab oma keemilise koostise pärast iga vahepealsete keemiliste interaktsioonide tsüklit.
Teisisõnu, katalüüsi olemus on keemiliste reaktsioonide kiiruse muutmine katalüsaatorite toimel.
Katalüsaator- ained, mis muudavad keemilise reaktsiooni kiirust või põhjustavad seda, kuid EI kuulu toodete hulka.

Katalüsaatorid liigitatakse homogeenne Ja heterogeenne. homogeenne katalüsaator on ühes faasis reageerivate ainetega, heterogeenne - moodustab iseseisva faasi, mis on eraldatud liidesega faasist, milles asuvad reageerivad ained. Tüüpilised homogeensed katalüsaatorid on happed ja alused. Heterogeensete katalüsaatoritena kasutatakse metalle, nende oksiide ja sulfiide.
Sama tüüpi reaktsioonid võivad toimuda nii homogeensete kui ka heterogeensete katalüsaatoritega. Seega kasutatakse koos happelahustega tahket Al 2 O 3, TiO 2, ThO 2, aluminosilikaate ja happeliste omadustega tseoliite. Aluseliste omadustega heterogeensed katalüsaatorid: CaO, BaO, MgO.
heterogeensed katalüsaatorid neil on reeglina väga arenenud pind, mille jaoks need on jaotatud inertsele kandjale (silikageel, alumiiniumoksiid, aktiivsüsi jne).
Heterogeenseid katalüsaatoreid kasutatakse üksikute ainete kujul harva ja need sisaldavad reeglina kandjat ja mitmesuguseid lisandeid, mida nimetatakse modifikaatoriteks. Nende kasutuselevõtu eesmärgid on erinevad: katalüsaatori (promootorite) aktiivsuse, selektiivsuse ja stabiilsuse suurendamine ning mehaaniliste ja struktuursete omaduste parandamine. Faasi- ja struktuurimodifikaatorid stabiliseerivad vastavalt aktiivse faasi ja katalüsaatori pinna poorse struktuuri.
Segakatalüsaatorites, kus komponente on proportsionaalses koguses (näiteks alumiinium-koobalt või alumiinium-nikkel-molübdeen katalüsaatorites nafta lähteainete hüdrotöötluseks), uued, aktiivsemad ühendid, nende tahke lahus põhikomponendis või mitmefaasiline saab moodustada spetsiifilise katalüütilise toimega süsteeme. Seega on Co või Ni üksinda kõrge dehüdrogeenimisaktiivsusega, kuid on äärmiselt tundlikud väävliühendite mürgistusmõju suhtes. Mo on selles reaktsioonis inaktiivne, kuid sellel on kõrge afiinsus väävliühendite suhtes. Katalüsaatorid, milles Mo ja Co või Ni on samaaegselt optimaalses vahekorras, on väga tõhusad väävli ja muude nafta lähteaine heteroorgaaniliste ühendite hüdrogenolüüsi reaktsioonides.
Mitte vähem oluline pole kandjate roll heterogeensete katalüsaatorite puhul, eriti kallite metallkatalüsaatorite (Pt, Pd, Ni, Co, Ag) puhul. Kanduri valikuga saavutatakse vajalik poorne struktuur, eripind, mehaaniline tugevus ja kuumakindlus. Kandjatena kasutatakse alumiiniumoksiide, alumosilikaate, kroomi või ränioksiide, aktiivsütt, pimsskivi, diiseli ja muid looduslikke ja sünteetilisi materjale. Eriklassi esindavad tseoliiti sisaldavad alumosilikaatkatalüsaatorid nafta lähteaine krakkimiseks. Nendes mängivad põhirolli kristalsed tseoliitid, millel on karkassstruktuuriga suhteliselt suured kärjeõõnsused, mida ühendavad õõnsusi omavahel ühendavad väikesed aknad. 1 g tseoliidis on umbes 1020 õõnsust ja 800 m2 pinda, mis on võimeline ioonivahetuseks metallide vastu. Tseoliidid dispergeeritakse amorfses maatriksis, mis toimib suurte pooridega kandjana ja soodustab pragunemise ajal kõrgmolekulaarse õli lähteaine esmast lagunemist ning valmistab seeläbi lähteaine ette järgnevateks tseoliidil toimuvateks sekundaarseteks reaktsioonideks.

Ülaltoodu põhjal võime järeldada, et tööstuslikud katalüsaatorid koosnevad: maatriksid (vedaja ), aktiivne komponent Ja abistavad lisandid või lisandid. Sõltuvalt interaktsiooni mehhanismist on kasutatavad katalüsaatorid "sorptsioon" ja "immutamine".
"Sorptsioon" - valmistamise protsessis toimub kandja ja pinnale adsorbeeritud algaine vaheline interaktsioon. "Immutamine" - selline interaktsioon praktiliselt puudub ja aktiivse komponendi algühend on kandja poorides lahustunud olekus.
Kasutatavate katalüsaatorite iseloomulikuks omaduseks on aktiivse komponendi ebaühtlane jaotumine graanuli ristlõikes. Neli peamist tüüpi: I - ühtlase jaotusega; II - "koorik", milles aktiivne komponent on kontsentreeritud graanulite perifeeriasse; III - aktiivne komponent on kontsentreeritud graanuli keskele ("munakollane"); IV - aktiivne komponent asub keskmises piirkonnas, eemal nii katalüsaatori tera keskelt kui ka välispinnast.

Maatriks peab tagama katalüsaatori katalüütiliste omaduste säilimise kõrgel temperatuuril, kaitsma seda katalüütiliste mürkide mõju eest, looma osakestele kindla kuju, osakeste suuruse jaotuse ja vajaliku mehaanilise tugevuse ning tagama aktiivsete metallide kättesaadavuse. lähteaine molekulide jaoks. Maatriksaine aitab kaasa aktiivsete metallide ühtlasele jaotumisele katalüsaatori poorides ning massi- ja soojusülekandeprotsesside intensiivsele voolule. See mõjutab oluliselt katalüsaatori termilist stabiilsust.

Katalüsaatorite peamised tehnoloogilised omadused on aktiivsus ja selektiivsus (selektiivsus) antud reaktsiooni suhtes, stabiilsus ja regeneratsioon, samuti osakeste suuruse jaotus, tihedus, mehaaniline muljumistugevus ja hõõrdumine.
Katalüsaatori aktiivsus- määratakse antud katalüütilise reaktsiooni spetsiifilise kiirusega, st ajaühikus moodustunud produkti kogusega katalüsaatori või reaktori mahuühiku kohta. Aktiivsus kvantifitseeritakse reaktsiooni kiirusena antud tingimustes miinus sama reaktsiooni kiirus katalüsaatori puudumisel. Katalüsaatori aktiivsuse kadu toimub peamiselt koksi ladestumise tagajärjel selle kandja pinnal ja poorides.
Heterogeense katalüsaatori aktiivsed kohad- spetsiifilised keskused tahke aine (või makromolekuli) pinnal, millega interaktsioonil aktiveeruvad reaktiivi molekulid ja reaktsioon kulgeb suurema kiirusega ( katalüütiliselt aktiivne ei ole heterogeense katalüsaatori kogu pind, vaid ainult osa sellest). Homogeense katalüüsi korral on ideaaljuhul kõik lahustunud katalüsaatori molekulid vahelduvvoolud ja moodustavad reaktiividega reaktiivseid vaheprodukte.
Enamikul juhtudel toimub selle katalüsaatori juuresolekul lisaks põhireaktsioonile ka rida paralleelseid või järjestikuseid külgreaktsioone. Iseloomustab reageerinud lähteainete osakaal sihtproduktide moodustumisel selektiivsus katalüsaator. See ei sõltu ainult katalüsaatori olemusest, vaid ka katalüütilise protsessi parameetritest, seetõttu tuleks see omistada teatud reaktsioonitingimustele. Selektiivsus sõltub ka termodünaamilisest tasakaalust. Nafta rafineerimisel väljendatakse mõnikord selektiivsust tinglikult sihtmärgi ja kõrvalsaaduste, nagu bensiin/gaas, bensiin/koks või bensiin/gaas + koks, saagise suhtena.

Stabiilsus on üks olulisemaid katalüsaatori kvaliteedinäitajaid, iseloomustab selle võimet oma aktiivsust aja jooksul säilitada. See määrab kindlaks tehaste töö stabiilsuse, nende kapitaalremondi kestuse, tehnoloogilise disaini, katalüsaatori kulu, materjali- ja majanduskulud, keskkonnaprobleemid ning protsessi tehnilised ja majanduslikud näitajad jne.
Pikaajalise töö käigus toimuvad katalüsaatorites teatud intensiivsusega füüsikalis-keemilised muutused, mis põhjustavad nende katalüütilise aktiivsuse (mõnikord selektiivsuse) vähenemist või kadumist, st katalüsaatorid läbivad füüsikalise ja keemilise deaktiveerimise.
Füüsiline saastest puhastamine (paagutamine) katalüsaator tekib kõrge temperatuuri (mõnedes katalüütilistes protsessides) ja veeauru mõjul ning selle transpordi ja ringluse ajal. Selle protsessiga kaasneb nii katalüsaatori kandja (maatriksi) kui ka aktiivse komponendi eripinna vähenemine (rekristalliseerimise tulemusena - ladestunud metalli ühinemine koos dispersiooni kadumisega).
Keemiline saastest puhastamine katalüsaator määratakse:
selle aktiivsete kohtade mürgitamine mõnede tooraines sisalduvate lisanditega, mida nimetatakse mürgiks (näiteks väävliühendid alumiiniumoksiid-plaatina reformimise katalüsaatorite puhul);
selle aktiivsete tsentrite blokeerimine süsihappegaasi (koksi) või nafta lähteaines sisalduvate metallorgaaniliste ühenditega.
Sõltuvalt sellest, kas pärast katalüsaatori regenereerimist katalüütiline aktiivsus taastub või mitte, eristatakse pöörduvat ja pöördumatut deaktiveerimist. Kuid isegi pöörduva deaktiveerimise korral katalüsaator lõpuks "vananeb" ja see tuleb reaktorist välja laadida.
avaldab olulist mõju tööstusprotsessidele mehaaniline tugevus katalüsaator. Seega kasutatakse kõigis kaasaegsetes katalüütilise krakkimise seadmetes katalüsaatori pideva liikumise põhimõtet - keevkihi kujul, mööda pneumaatilist transpordiliini või harvemini jämedalt granuleeritud osakeste kihina. Osakesed hõõrduvad ja löövad igal juhul vastu seadme seinu ja üksteist, mille tulemusena võivad nad lõheneda või kuluda. Katalüsaatorilaastude ja tolmu moodustumine rikub pneumaatilise transpordi ja keevkihi moodustumist, suurendab rõhulangust liinis. Saadud tolm ja puru eemaldatakse, mistõttu on vaja need asendada värskete katalüsaatori osadega, mis suurendab tehase käitamiskulusid. Katalüsaatorite mehaaniline tugevus määratakse proovide hõõrdumise meetodiga tsirkulatsioonisüsteemis - keevkihis, osakeste samaaegsel löömisel metallpinnale jne.
Katalüsaatori teine omadus on selle taastatavus. Katalüsaatori regenereeritavuse all mõistetakse nii selle võimet taastada aktiivsus pärast asjakohast töötlemist kui ka regenereerimisprotsessi kvantitatiivseid omadusi, eelkõige selle kiirust.
Selle valmistamise meetodil on suur mõju katalüsaatori kvaliteedile. Kuna katalüütiline reaktsioon kulgeb pinnal, on soovitatav saada kõige arenenuma pinnaga katalüsaator, millel on palju poore. Erinevate reaktsioonide jaoks võivad optimaalsed olla kitsad või vastupidi laiemad poorid, aga ka nende kombinatsioonid. Sama oluline on katalüsaatoriterade kuju ja suurus - sellest sõltub eritootlikkus, katalüsaatorikihi hüdrauliline takistus ja reaktsiooniaparaadi (paigalseisva, liikuva või keevkatalüsaatorikihiga) konstruktsioon. Lisaks ei sõltu katalüsaatori pinnaühiku aktiivsus mitte ainult selle keemilisest koostisest, vaid ka selle valmistamise meetodist.
Redutseerimine ja oksüdatsioon on lahutamatult seotud protsessid. Kui üks reaktsioonis osalevatest ainetest redutseeritakse, siis teine oksüdeerub. Seetõttu on mõnede reaktsioonide omistamine oksüdatsioonireaktsioonidele ja teiste redutseerimisreaktsioonidele seotud sellega, milline aine on antud juhul sihtprodukt.Taastumine on protsess, mille käigus aatom või aatomite rühm omandab elektrone. Vastupidi, oksüdatsioon on elektronide kadu.
Täpsemalt on see umbes elektronpilvede tiheduse muutus , mis ümbritseb vaadeldavat aatomite rühma. Taastamisel see suureneb , ja oksüdeerumisel väheneb . Näiteks on joodiooni ja kloori molekuli vaheline reaktsioon:
Aatomis või aatomirühmas oleva elektronpilve suuruse määramiseks kasutatakse mõistet "oksüdatsiooniaste".
Redoksprotsessides koos molekuli elektronpilve ümberjaotumisega tavaliselt muudatusi ja tema koostis . Näiteks kaksiksideme taastamisel molekul omandab kaks vesinikuaatomit :
ja alkoholide või nitroühendite redutseerimisel molekul kaotab hapniku aatomid :
Paljusid redutseerimis- ja oksüdeerimismeetodeid võib jagada neli rühma
: keemiline, katalüütiline, elektrolüütiline ja biokeemiline (mikrobioloogiline). Kõiki neid meetodeid kasutatakse farmaatsiatööstuses laialdaselt.
^
Keemilised meetodid
Keemilised taaskasutusmeetodid võib vastavalt redutseerija tüübile jagada mitmeks rühmaks.
1. Taaskasutamine metallide ja metallisooladega
^1.1. Naatriumi taastumine
A) Naatriumi vähendamine alkoholis (vastavalt Bouvot - Blancile) kasutatud taastumine karboksüülhapete estrid vastavatele alkoholidele. Meetod on suurima tähtsusega kõrgemate alifaatsete alkoholide sünteesil, mida on raske muul viisil saada. Polübaashapete sisaldus väheneb ainult esterdatud karboksüülrühmad .
Kokku reaktsiooni võrrand paistab nagu:
Mehhanism taastumist võib esitada järgmiselt:
Väljund sihttooted on tavaliselt ei ületa 80% . Kaod on tingitud otsesest reaktsioonist naatriumi ja alkoholi vahel. Vabanenud vesinik on mitteaktiivne ning tekkivad alkoholaadid põhjustavad kondenseerumist ja ümberesterdamist ning kõrge keemistemperatuuriga kõrvalsaaduste moodustumist.
Metoodika taastumine Bouveau ja Blanci sõnul lihtne, kuid ohtlik.
Metallist naatriumi tükid, mis on võetud kerges liias, lisatakse osade kaupa estri ja viiekordse absoluutse alkoholi koguse keevale segule. Pärast kogu naatriumi laadimist ja vajalikku kokkupuudet valatakse reaktsioonimass vette, et moodustunud alkoholaadid lagundada. Alkohol destilleeritakse välja ja reaktsiooniproduktid ekstraheeritakse ekstraheerimisega.
Soojuse hajumine on keeruline tehniline probleem, sest reaktsiooni termiline efekt on väga kõrge (520 kJ/mol). Hästi toimiva (tõhusa) reverse kasutamine on hädavajalik külmkapp . Reaktsioonimassi jahutamise hõlbustamiseks ja protsessi ohu vähendamiseks on võimalik protsessi temperatuuri tõsta etüülalkoholi asendamise teel. kõrge keemistemperatuuriga alkoholid sealhulgas amüül. Jah, taastumine. sebatsiinhappe dietüülester viidi läbi 1-butanoolis .
Sebatshappe dietüülester lahustatakse veevabas butüülalkoholis, seejärel lisatakse mitmes etapis 70 °C juures intensiivselt segades naatrium. Temperatuur tõstetakse 100-125°C-ni. Toote saagis 72%.
Ohu vähendamiseks difenüülpropioonhappe etüülestri redutseerimine tootmisel difrilalaadimise järjekord reaktiivid on vastupidised, nimelt lisatakse naatriumile eetri alkoholilahust:
See võimaldab täielikult ära kasutada metallilist naatriumi, mis standardmeetodil ei pruugi osaliselt reageerida ja jääda reaktsioonimassi, mis tekitab ohu reaktsioonimassi veega lahjendamisel.
^ B) Naatriumi redutseerimine vedelas ammoniaagis - rakendatud taastumine:
aga) estrid alkoholidele (parem kui Bouvo-Blanc)
B) alküünid olefiinidele (sel juhul ei taastu kolmikside ahela lõpus)
IN) orgaanilised halogeniidid, mis käib kahes suunas:
Mehhanism sarnane Bouvot-Blanci taastamismehhanismiga
Leelismetallid (kaalium, naatrium ja liitium) lahustuvad hästi ammoniaagis ja võimaldavad laias kontsentratsioonivahemikus . Ammoniaagi madal dissotsiatsiooniaste võimaldab taastada vees hüdrolüüsitud ühendeid. Ammoniaak võib moodustada naatriumiga amiidi, kuid katalüsaatorite puudumisel ja redutseeritavate ühendite juuresolekul pole sellel protsessil praktilist tähtsust.
Protsessi käivitamiseks on vaja erivarustus, sest temperatuuri ammoniaagi keemistemperatuur on väga madal (-33,5°C). Reaktsioon viiakse läbi kõrgemal temperatuuril autoklaavis . Segu homogeensuse saavutamiseks on vajalik energilinesegamine .
C) Taastamine naatriumamalgaamiga(naatriumi lahus elavhõbedas)
naatriumamalgaam mitte ainult naatriumi lahus elavhõbedas. Elavhõbe moodustub leelis- ja leelismuldmetallidega elavhõbedad MeHg x (näiteks NaHg 2, KHg 2, MgHg).
Vähem sisaldav amalgaam 1,25% naatriumi , toatemperatuuril vedel . Suuremate naatriumikontsentratsioonide korral muutub amalgaam toatemperatuuril tahke ja seda saab mehaaniliselt purustada.
Protsess naatriumi lahustamine elavhõbedas viiakse läbi tolueenikihi all ja lämmastikuatmosfääris, et kaitsta sooja amalgaami õhuhapniku kokkupuute eest. Tuleb märkida, et naatriumi lahustumisprotsess elavhõbedas on eksotermiline. Reaktsioonisoojuse eemaldamine põhjustab teatud raskusi, kuna. vee kasutamine külmutusagensina on välistatud. Tavaliselt valmistatakse amalgaam temperatuuril 40-50 °C, saades seeläbi 2-3% amalgaami.
Kõige puhtam vedel ja saadakse homogeenne amalgaam, mis sisaldab kuni 0,5% naatriumi elektrolüütiline meetod.
^ naatriumamalgaam taastama:
aga) konjugeeritud kaksiksidemed (kuid mitte isoleeritud)
b) areenide üksikud esindajad, nt ftaalhapped, aromaatsed polütsüklilised süsivesinikud (di- või tetrahüdroderivaatideks).

IN) karbonüül Grupp aldehüüdides ja ketoonides vastavateks alkoholideks (väga lihtne!).
G) Nitro - ja muud lämmastikku sisaldavad rühmad (väga lihtne), kuid see meetod ei ole saanud praktilist väärtust kättesaadavamate redutseerivate ainete olemasolu tõttu.
Mehhanism naatriumamalgaami taastamine - iooniline . Metallpinnal olevas adsorptsioonikihis on substraadi molekuli külge kinnitatud üks või kaks elektroni. Seejärel ühinevad tekkivad anioonsed radikaalid või kahekordse laenguga anioonid prootonitega:
Taastamismeetod: substraat lahustatakse või suspendeeritakse alkohol või vesi sest Naatriumamalgaam reageerib aeglaselt veega. Mõnel juhul reaktsiooni kiirendamiseks orgaanilised lahustid, vee ja alkoholiga segunev, substraadi paremaks lahustumiseks või emulgeerivad rajatised. Segule lisatakse järk-järgult amalgaami liig ( 25-40% teoreetilisest ) . Pärast amalgaami täielikku lagunemist eraldatakse eraldunud elavhõbe dekanteerimisega ja pestakse vee või alkoholiga.
Kiirus
, ja mõnikord sõltub taastustoodete koostis pH väärtusest
, mis reaktsiooni käigus suureneb, samas kui reaktsiooni kiirus aeglustub. PH väärtuse täpne ja pidev kontroll toimub potentsiomeetriliselt. PH väärtust reguleeritakse CO 2 läbilaskmisega.
^
1.2. Taaskasutamine tina ja tina(II)kloriidiga
- lihtne ja ammu tuntud taastumisviis nitro-, nitroso-, hüdroksüamino-, aso- ja diasorühmad.
Seda kasutatakse laialdaselt laboripraktikas, kuid mitte tööstuses (majanduslikel põhjustel).
^ A) Taastamine tinaga eriti kasulik teisendamiseks aromaatsed nitroühendid (nagu ka nitrosoühendid ja alküülhüdroksüülamiinid) amiinideks , mida kasutatakse laialdaselt ravimite sünteesi vaheühenditena. Taastamise tulu astmeliselt vaheühenduste seeria kaudu:
Protsessi võrrand :
Algselt moodustunud tina(II)kloriid võib redutseerijana interakteeruda nitroühenditega:
^ Tina taastamine . Lahuse või suspensiooni jaoks nitroühendid kontsentreeritud vesinikkloriidhappes, mis on võetud kerges liias, lisatakse osade kaupa granuleeritud tina. Reaktsioon käivitatakse reaktsioonisegu ettevaatliku kuumutamisega veevannil pärast esimese tinakoguse laadimist. Kui laaditakse palju tina, algab reaktsioon liiga ägedalt ja selle väljutamise vältimiseks on vaja reaktsioonimassi kiiret jahutamist. Reaktsioon viiakse reeglina läbi, hoides reaktsioonimassi (püstjahuti) rahulikku keemist, kuni saadakse selge lahus. Kuum lahus filtreeritakse seejärel kiiresti reageerimata tinast läbi vesinikkloriidhappe suhtes vastupidava filtri. Filtraat, mis sisaldab amiini komplekssoolana tinakloriididega, leelistatakse ammoniaagi või leelisega. Kui reaktsioonisaadus destilleeritakse veeauruga, destilleeritakse see otse reaktsioonimassist välja. Muudel juhtudel ekstraheeritakse amiin sobiva lahustiga.
^ B) Taaskasutamine tina(II)kloriidiga võimaldab pakkuda tugevam ja spetsiifilisem taastav toime ja annab sageli paremaid tulemusi kui metallist tina taastamine.
Tina(II)kloriid taastab nitro - Ja asoühendid amiinidele , diasooniumi soolad arüülhüdrasiinile, valikuliselt taastab nitrorühmad polünitro-, heterotsüklilistes ja halonitroühendites:
kõige selgemalt selektiivsus redutseerimine avaldub kolme asendatud benseeni derivaatides, mille positsioonides 2 ja 4 on kolmanda asendaja suhtes kaks nitrorühma. Seega redutseerib tinakloriid 2,4-dinitrotolueenis nitrorühma positsioonis 2, praktiliselt ilma positsioonis 4 olevat nitrorühma mõjutamata.

Meetod võimaldab teil taastada homogeenses keskkonnas sest tinakloriid lahustub vees ja etüülalkoholis. Tänu sellele toimub redutseerimine kiiresti, hea saagisega ja madalatel temperatuuridel, kuigi reaktsiooni saab läbi viia ka keemistemperatuuril. Tinakloriidiga taandamise läbiviimine ei tekita erilisi raskusi ega erine põhimõtteliselt tinaga redutseerimise meetodist. Reaktiivide laadimise järjekord ei oma tähtsust.
Tina taastamine
Parim on läbi viia elektrokeemiline meetod. See meetod võimaldab teil tsüklisse naasta peaaegu kogu tina. Laboratoorses praktikas kasutatakse mõnikord tina sadestamist lahustumatu sulfiidi kujul, kui vesiniksulfiid juhitakse läbi reaktsioonimassi.
^
1.3. Tsingi taastumine
Tsingiga redutseerimine tööstuses toimub nii happelises kui aluselises keskkonnas. Taastamiseks kasutatakse ka tsinkamalgaami.
^ A) Happelises keskkonnas tsink väheneb : karbonüülühendid alkoholidele, areensulfoonkloriidid tiofenoolidele, kaksikside -küllastumata karbonüülühendites aga praktiline väärtus on ainult taastumine nitro-, nitroso- ja muud lämmastikku sisaldavad rühmad vastavateks amiinideks.

Sünteesil sarkolüsiin Tsingitolm vesinikkloriidhappe keskkonnas taastab "aslaktooni", mille järel saadud bensoüülsarkolüsiin hüdrolüüsitakse:


![]()
Taastumine sipelghappesöötmes võib kaasneda saadud aminorühma formüülimine:


B) Tsink aluselises keskkonnas taastab:
a) karbonüül ühendused alkoholidele
b) halogeeni derivaadid süsivesinikeks
sisse ) nitroareenid aso-, hüdrasoühenditeks ja edasi amiinideks:
Hüdrasoühendite kättesaamisel tavaliselt kasutada tsingi tolm , millel on suur eripind, ja koormata seda 10-15% rohkem kui teoreetiliselt arvutatud kogus. Naatriumhüdroksiid reaktsioonis ei tarbita sest tekkiv tsinkaat hüdrolüüsitakse reaktsioonitingimustes, saades tsink- ja naatriumhüdroksiidid. Seetõttu võtavad leelised teooria järgi 5-100 korda vähem kui vaja.
kõrge leelise kontsentratsioon võib viia amiini moodustumiseni koos hüdrasoühendiga. Ebapiisava leeliselisuse korral on taastumine aga aeglane. Seetõttu on protsess jagatud kaks etappi . Esiteks viiakse redutseerimine läbi kontsentreeritud leelis temperatuuril 80-90 °C kuni asoksü- ja asoühendite moodustumiseni ning tsingitolmu ja leelise range doseerimiseni. Seejärel redutseeritakse moodustunud ühendid uue tsingitolmu portsjoniga, kuid juba lahjendatud leeliselahuses temperatuuril 65-70 °C.
Taastumisel kontroll temperatuur, keskkonna pH ja lahuse värvus. Redutseerimisel tekkinud asoühendid on intensiivse värvusega ja edasisel redutseerimisel annavad värvituid hüdrasoühendeid. Reaktsioon peatatakse kohe pärast pleegitamist lahendus, kuna edasine redutseerimine võib põhjustada amiinide ilmumist reaktsioonimassi.
Hüdrasoühend sadestub koos tsinkhüdroksiidiga. Hüdroksiid lahustatakse reaktsioonimassi ettevaatlikul hapestamisel neutraalseks ja hüdrasoühend filtritakse välja .
Edukas taastumine nõuab segage intensiivselt üsna viskoosne mass, millesse on mõnikord lisatud viskoossuse vähendamiseks orgaanilisi lahusteid. Sel juhul lähevad reaktsiooniproduktid lahusesse, mis hõlbustab nende eraldamist.
Nitroühendite redutseerimine tsingiga leeliselises keskkonnas toimub terases või malmis seadmeid ankrusegisti ja jopega.
^ B) Tsink amalgaam vesinikkloriidhappes ( Clemmenseni meetod ) asendab karbonüülhapnik rühmad kaks vesinikuaatomit:

Reaktsioon toimub kuumutamisel vees-alkoholis keskkondades , mõnel juhul äädikhappekeskkonnas või inertsetes lahustites.
Hüdroksüühendid nendes tingimustes ei redutseerita, mis näitab, et CO rühma redutseerimine ei läbi alkoholi moodustumise etappi
^
1.4. Raua taastumine
A) Raud elektrolüütide juuresolekul taastab aromaatsed nitroühendid
vastavateks amiinideks (üks levinumaid tööstuslikke meetodeid). Samal ajal neli reaktsioonid
:
Protsessi kiirus taastumine piirdub esimese etapiga, mis sarnaneb raua märgkorrosiooni protsessiga. Seetõttu toimub taaskasutamine keskkonnas elektrolüüt , tavaliselt, kergelt happelises keskkonnas . Koos väärtuse tõusuga keskmine pH reaktsioonikiirus väheneb. Kui pH > 12, protsess praktiliselt peatub.
elektrolüüdid süstitakse reaktsioonimassi valmis kujul (ammooniumkloriid) või saadakse reaktoris endas malmilaastude peitsimisel vesinikkloriidhappega. Enamik aktiivne elektrolüüt on ammooniumkloriid, vähem aktiivne raud(II)kloriid, ammooniumsulfaat jne.
Parim viis taastamiseks on kasutada hallid rauast laastud , mis on metallitööstuste raiskamine. Tegevus hallmalmi seletatakse galvaanilise paari elektrolüütide esinemisega liideses: raud-grafiit. Granuleeritud struktuuri tõttu laguneb hallmalm redutseerimisprotsessi käigus väikesteks osakesteks, mis põhjustab reaktsiooni kiirenemist.
Malm peab olema spetsiaalselt ette valmistatud reaktsiooni eest. Pärast purustamist ja sõelumist, samuti tolmu eemaldamist malmist laastud rasvatustatakse ja marineeritakse väikese koguse vesinikkloriidhappega, mis suurendab selle aktiivsust kloriidide moodustumise tõttu.
Taastamisprotsess malmist laastud temperatuuril reaktsioonimassi keetmine. Kütmine toimub enamasti elava auruga.
Tavaliselt laaditakse nitroprodukt järk-järgult keemistemperatuurini kuumutatud elektrolüüdi lahuses olevate malmist laastude suspensiooni. Iga järgmine portsjon manustatakse alles pärast seda, kui eelmine on reageerinud. Mõningatel juhtudel laadimise järjekord saab muuta.
Kui tulemuseks amiin lenduv auruga, osa sellest destilleeritakse auruprotsessi käigus ära. Vee- ja amiiniaurude segu kondenseeritakse külmikus, misjärel see siseneb eraldamiseks settepaaki. Ülejäänud amiin destilleeritakse välja auruga pärast taastumisprotsessi lõppu ja reaktsioonimassi leelistamist. Mõnikord sifoonitakse eelnevalt vabastatud amiin pärast reaktsioonimassi settimist redutseerijas. Amiinid, veeauruga halvasti destilleeritud, väljavõte reaktsioonimassist orgaaniliste lahustitega.
Tootmises toimub redutseerimine terasest või malmist seadmeid (käigukastid), vooderdatud diabaasplaatidega happekindlal pahtlil ning varustatud segistiga (tera või seemendiga) ja mullitajaga elava auru varustamiseks.
See meetod kasutada anestesiini, novokaiini, difenüülsulfooni ja paljude teiste ravimite tootmisel:
Meetodi eelised : tehnoloogia lihtsus, madalad toorainekulud, sihtreaktsiooniprodukti kõrge saagis. miinused : toorainebaasi vähenemine ja malmlaastude ebastabiilne kvaliteet; raskused tekkinud muda kõrvaldamisel (filtreerimine, abrasiivseid osakesi sisaldava halvasti filtreeritud raske setete transport).
^ B) Rauaviilid vesinikkloriid- või äädikhappe keskkonnas - nitroühendite taastamine , asoühendid Jaaldehüüdid .

Protsess viiakse läbi keemistemperatuuril, lisades aeglaselt nitroühendi raua suspensioonile kergelt happelises vesi- või vesinikalkoholilahuses. keskkond . Alkoholi kontsentratsioon võib oluliselt mõjutada. Parimad tulemused saavutatakse sellega töötades raud redutseeritud vesinikuga. Väikese koguse lisamine nikkelkloriid kiirendab reaktsiooni.
^ C) Raudsulfaat (II) ammoniaagi juuresolekul - taastab nitrorühma teisi redutseeritavaid rühmi sisaldavate ühendite molekulides. See meetod annab häid tulemusi aromaatsete nitrokarboksüülhapete ja nitroaldehüüdide redutseerimisel.
^
1.5. Alumiiniumalkoholaatide redutseerimine (Meerwein-Ponndorf-Werley meetod)
alumiiniumalkoholaadid taastama
aromaatsed ja alifaatsed karbonüülühendid
vastavateks alkoholideks, mõjutamata
muud funktsionaalsed rühmad.
Reaktsiooniskeem:

Tavaliselt kasutatakse taastumiseks alumiiniumisopropoksiid isopropüülalkoholis; harvemini - alumiiniumetoksiid etüülalkoholis (aldehüüdide redutseerimiseks).
Taastumine läheb alkoholi radikaali alkoholaadi tõttu , mis oksüdeeritakse karbonüülühendiks. Saadud uut alumiiniumalkoksiidi saab alkoholiseerida lahusti toimel, mille käigus alumiiniumisopropoksiid regenereeritakse. Sellepärast alkoholaadid mängida peamist rolli katalüsaator. Parima tulemuse annab aga alkoholaat kogustes 1 mool või rohkem substraadi mooli kohta.
Sihttoode (alkohol) eraldama töödeldes saadud alumiiniumalkoholaati lahjendatud väävelhappega. väljub sihttooted moodustavad tavaliselt 80–95%.
Aldehüüdid taastatakse palju lihtsam , kuidas ketoonid ruumilise faktori väiksema mõju ja karbonüüli süsinikuaatomi suurema elektrofiilsuse tõttu. Aldehüüdid, nagu näiteks furfuraal, vähenevad külmas.
alumiiniumalkoholaadi redutseerimisprotsess pööratav, nii tavaliselt tehakse kuumutamisel madala keemistemperatuuriga komponendi (atsetooni) destilleerimisega, mis aitab kaasa sihtsaaduse moodustumisele.
Reaktsiooniaeg sõltub suuresti substraadi olemusest. Kui protsessi aeg on liiga pikk, saab reaktsiooni temperatuuri tõsta kõrgema keemistemperatuuriga lahusti (tolueen, ksüleen) abil. Siiski tõus temperatuuri suurendab kõrvalreaktsioonide kiirust suuremal määral kui peamine. Reaktsioonisegule lisamisega on võimalik reaktsiooni oluliselt kiirendada ja suurendada sihtprodukti saagist Raney nikkel või alumiiniumkloriid. Pikaajalise aldehüüdi redutseerimise või õhus ebastabiilsete toodete moodustumise korral juhitakse reaktsioonimassi läbi lämmastik või vesinik.
Meerwein-Ponndorfi taastumist kasutatakse levomütsetiini, metatooni, fetanooli ja paljude teiste ravimite sünteesil:

^
1.6. Taastamine metallhüdriididega
Metallhüdriididel, eriti liitiumalumiiniumhüdriidil (LiAlH 4 ) ja liitiumboorhüdriidil LiBH 4 või naatrium NaBH 4 , on tugevad redutseerivad omadused ja neid kasutatakse süsinik-heteroaatomi kaksiksidemega polaarsete ühendite redutseerimiseks.
^ A) liitiumalumiiniumhüdriid - kompleksne soolataoline ühend valemiga Li AlH 4 -, mis lahustub aeglaselt eetrites koos uute komplekside moodustumisega - eetrid .
liitiumalumiiniumhüdriid taastab:


karbonüül ühendused, karboksüülhapped ja kõik neid hapnik ja halogeenitud derivaadid alkoholidele, lämmastikku sisaldavad derivaadid ja alifaatsed nitroühendid - amiinidele ja ka halogeniidid Ja alkoholid - süsivesinikele.
Redutseerimise hõlbustamiseks saab substraadid järjestada järgmises järjekorras: aldehüüdid > ketoonid > estrid > anhüdriidid > happed > nitriilid > amiidid > nitrorühmad.
Liitiumalumiiniumhüdriid taastab peaaegu kõik süsiniku-heteroaatomi sidemed, kuid mitte süsinik-süsinik kaksiksidemed . Sellised selektiivsus võimaldab taastada funktsionaalrühmi küllastumata süsivesinikes.
Taastumine voolab sisse kerged tingimused ja tavaliselt suure saagikusega . Oluliselt ekvimolaarse koguse alumiiniumkloriidi lisamine liitiumalumiiniumhüdriidile suureneb selle redutseeriv toime, mis on ilmselt tingitud alumiiniumhüdriidi ja liitiumkloriidi moodustumisest.
Toimub liitiumalumiiniumhüdriidi redutseerimine veevabas keskkonnas , tavaliselt, eetris . Dietüüleetri asemel võib lahustitena kasutada tetrahüdrofuraani, dibutüüleetrit, morfoliini jt. Nende lahustite kasutamine võimaldab redutseerida kõrgemal temperatuuril kui dietüüleetris. Substraadi lahustuvuse suurendamiseks segatakse estreid mõnikord benseeni või tolueeniga.
Töötamine liitiumalumiiniumhüdriidiga nõuab erilisi ettevaatusabinõusid . Oluline on vältida liitiumalumiiniumhüdriidi kokkupuudet veega, kuna see põhjustab toote ägedat lagunemist, mille käigus eraldub koheselt süttiv vesinik. Ettevaatust dehüdratsioon lahustid on liitiumalumiiniumhüdriidiga töötamise eeltingimus.
Liitiumalumiiniumhüdriidi kasutatakse:
a) taastada sebatshappe etüülester parema saagisega kui teistel meetoditel (seenevastase ravimi sünteesil dekamiin):
B) ühes pürimidiini komponendi sünteesi meetoditest vitamiin B 1 :

C) oktadiini sünteesil:

D) steroidsete ravimite sünteesil:

^ B) Naatrium (kaalium) boorhüdriidid on vähem aktiivsed reaktiivid kui liitiumalumiiniumhüdriid, kuid redutseerivad sellinepolaarsed lahustid nagu vesi, metanool, püridiin, atsetonitriil. Nad tavaliselt taastama ainult happekloriidid happed, karbonüül ühendused ja Schiffi alused .

Naatrium- ja kaaliumboorhüdriide kasutatakse laialdaselt valimiste taastumine karbonüülrühmad teiste funktsionaalrühmade ja küllastumata sidemete juuresolekul:
^
2. Taastamine väävliühenditega
Tööstuses kohaldada
harva
, sest seal on mugavamad redutseerivad ained ja kahjulikke väävliühendeid (vesiniksulfiid) sisaldava reovee kõrvaldamine põhjustab tõsiseid raskusi ( viga
). Esmakordselt kasutas sulfiidi sel eesmärgil N. N. Zinin, kes sai aniliini nitrobenseeni redutseerimisel ammooniumsulfiidiga.
^
2.1. Nitroühendite redutseerimine leelismetallide sulfiididega amiinideks
Nendel eesmärkidel kasutada - sulfiid
Ja polüsulfiidid
naatrium Na2Sn (n = 2, 3…) ja hüdrosulfiid
(sulfhüdraat) naatrium NaHS.
polüsulfiidid naatrium saada kuumutades Na 2 S lahust arvutatud väävlikogusega:
^ Reaktsiooniskeemid regenereerimine leelismetallide sulfiididega:
Nitroühendite taastamisel naatriumsulfiid suureneb söötme aluselisus, mis soodustab asovärvide teket ja vähendab sihttoote saagist ning halvendab selle kvaliteeti.
Taastumine trisulfiid Na 2 S 3 möödub koos väävli vabanemisega, mille vabanemine tekitab olulisi raskusi.
Taastumine hüdrosulfiid Ja naatriumdisulfit palju mugavam, kuid need tuleb enne kasutamist valmistada naatriumhüdroksiidi vesi- või alkoholilahuse küllastamisel arvutatud koguse vesiniksulfiidiga või naatriumsulfiidi sulatamisel väävliga.
^ taastumistehnika. soojendada temperatuuri 80-90°C või kuni keemiseni emulsioonid või peatused nitroühendid vees järk-järgult, koos tugev segamine Lisatakse 15-25% sulfiidilahust. Liigne sulfiid peaks olema 20-40% (täieliku taastumisega) ja osalise taastumisega - mitte rohkem kui paar protsenti. Kestus taastumine sõltub suuresti temperatuurist ja võtab tavaliselt mitu tundi.
Amiinid eraldama: tahke lahustumatu - filtreerimise või tsentrifuugimisega (nutsch filtrid, tsentrifuugid); vedelik lahustumatu - settides eralduslehtritesse; lahustub ekstraheerimise või väljasoolamise teel.
emajoogid töödeldakse õhuhapnikuga, et oksüdeerida ülejäänud sulfiidid Na 2 S 2 O 3 -ks. Saadud tiosulfaadi lahus aurutatakse ja puhastatakse aktiivsöega. Saadud kuum kontsentreeritud lahus jahutatakse ja eraldatakse tehniline tiosulfaat, mis puhastatakse ümberkristallimise teel.
Keskkond ei ole söövitav, seega reduktorina saab kasutada ümbrisega terasest või malmist seadmed ja propeller või turbiin segaja . Kuna protsess toimub sulfiidide lagunemise tõttu reaktsioonimassi keemisel, siis võib eralduda vesiniksulfiid ning reaktor peab olema varustatud püstjahutiga ja püüdmise süsteem vesiniksulfiid.
Aromaatsete nitroühendite taaskasutamine väävelleelistega rakendatud sisse tööstusharud umbes- Ja P- anisidiinid, umbes- Ja P-fenetidiinid, aminosalitsüülhape, aminofenoolid, m-nitroaniliin (alates m-dinitrobenseen), 1-naftüülamiin jne.

Taastumisel umbes-nitroanisooli raudlaastudel on toote eraldamisel märkimisväärseid raskusi. Kõik need raskused kaovad taastamisel umbes-nitroanisoolsulfiid või naatriumvesiniksulfiid. Seetõttu kasutatakse seda meetodit tööstuses vaatamata toote saagise vähenemisele 86-87% -ni ja keskkonnaprobleemidele.
^ Meetodi eelised : reaktsiooniprodukt paistab kergemini silma, tehnoloogia on lihtsam, korrosioon varustust oluliselt vähem, rohkem selektiivsust, kui malmist laastude kasutamisel. Meetod võimaldab selektiivselt redutseerida polünitroühendites ühte nitrorühma ilma ülejäänud või kõiki nitrorühmi mõjutamata ning nitroasoühendites taastada nitrorühma ilma asorühmi mõjutamata.
miinused: tootmine on ohtlik, vaja on eriseadmete tihendamist, keskkonnaprobleemid.
^
2.2. Väävli nitrorühma taastamine leeliselises keskkonnas.
Huvitav on see, et mõnel juhul (näiteks taastamine P-nitrotolueen solutisooni tootmisel) toimub metüülrühma samaaegse oksüdeerimisega aldehüüdiks:
^
2.3. Taastamine väävelhappe ja selle sooladega
Väävelhape ja selle soolad on nõrgad redutseerivad ained vesi- ja orgaanilises keskkonnas ning taastama: aga) sulfokloriidid
vastavateks hapeteks; b) kinoonid
- hüdrokinoonidele; sisse) nitrosoühendid
- enne aminosulfonaadid; d) diasooniumsoolade redutseerimine
enne arüülhüdrasiinid
:
^ Diasooniumisoolade taastamine on üks tähtsamaid reaktsioone naatriumsulfitiga.
Tavaliselt lisatakse äsja valmistatud (NaOH-st ja SO 2-st) ja jahutatud sulfitilahusele diasooniumsoola lahust. Seejärel hapestatakse reaktsioonimass segades ettevaatlikult vesinikkloriidhappega ja kuumutatakse veevannis. Reaktsiooni lõpuks peaks reaktsioonimassi oranž värvus muutuma kollaseks. Väike kogus moodustunud vaiguseid saadusi filtreeritakse välja ja saadus eraldatakse jahutatud filtraadist.
Diasoühendite redutseerimiseks võib kasutada ka vesiniksulfiti või väävelhapet. Arüülhüdrasiinide saagis on tavaliselt kõrge ja ulatub 90-95%.
^
2.4. Taastamine naatriumditioniidiga
Ditioonhape (H 2 S 2 O 4) vabal kujul on ebastabiilne ja seda kasutatakse soolade kujul. naatriumditioniit taastab diketoonid
hüdroksüderivaatideks; alifaatsed nitroühendid
- enne oksiimid
, aga aromaatne
- enne amiinid
; ja ka väga kerge ja kõrge saagikusega asoühendid amiinideks
:


Reaktsioon viiakse tavaliselt läbi leeliselises vesilahuses temperatuuril 40-90 °C.
^
Katalüütiline redutseerimine vesinikuga
Orgaaniliste ühendite redutseerimine vesinikuga katalüsaatorite juuresolekul muutub iga aastaga järjest olulisemaks. Voorused
meetodid on: 1) universaalsus; 2) protsessi suur kiirus; 3) saadud toodete puhtus ja 4) nende eraldamise lihtsus ning puudused 1) elektrolüütilise vesiniku ja kasutatavate katalüsaatorite nappus, 2) protsessi kõrge tule- ja plahvatusoht ning 3) vajadus kasutada paljudel juhtudel autoklaave.
^ Taastumise määr vesinik katalüsaatori pinnal (kontaktkatalüütiline redutseerimine) sõltub substraadi struktuurist . Hüdrogeenimise lihtsus üksikud rühmad, väheneb reeglina järgmises järjestuses: kaksiksidemed > nitro > karbonüül > nitriil > aromaatsed ja heterotsüklilised süsteemid > hüdroksüül > karboksüülrühmad .
See võimaldab teostada selektiivne hüdrogeenimine .
^ Suund ja väljapääs reaktsioonid sõltuvad nii protsessi tingimustest kui ka katalüsaatori valmistamise aktiivsusest ja meetodist. Tegevus katalüsaatoreid saab suurendada või vähendada spetsiaalsete ainete lisamisega ( promootorid ja inhibiitorid )
Kõige sagedamini kasutatav metallist katalüsaatorid, eriti elementide perioodilise süsteemi VIII rühma metallid, nende oksiidid, sulfiidid, kloriidid. Sõltuvalt toiduvalmistamisviisist eristada järgmist katalüsaatorite tüübid:
AGA) mob – väga peenelt dispergeeritud metall, mis sadestub tavaliselt selle soola lahusest redutseerimise teel;
B) Adamsi katalüsaatorid – peeneks jahvatatud plaatina või pallaadium, mis on saadud nende oksiidide redutseerimisel vesinikuga;
IN) skeleti katalüsaatorid (Raney katalüsaatorid) - saadakse kahekomponentsete sulamite (vastavalt nikkel, raud, vask või koobalt alumiiniumi või räniga) poorse ("käsna") massina sulami ühe komponendi lahustamisel happes või leelis;
G) toetatud katalüsaatorid - metall musta, oksiidide või soolade kujul, mis on ladestunud poorsele kandjale (pimss, silikageel, kivisüsi, leelismuldmetallide karbonaadid jne), et suurendada pinda ja vähendada kalli väärismetalli tarbimist;
D) oksiid- ja sulfiidkatalüsaatorid - vaskkromiidid, tsink, molübdeeni sulfiidid, volfram jne stabiilsed ja suhteliselt odavad tööstuslikud katalüsaatorid.
Seal on üsna suur numberhüpoteesid
püüdes selgitada vesinikuga katalüütilise redutseerimise mustreid. Mõned neist hüpoteesidest käsitlevad ennekõike katalüsaatori struktuuri, puudutamata küsimust reagentide ja katalüsaatori vahelise kemisorptsioonisideme moodustumise põhjuste kohta. Vastupidi, katalüüsi elektroonilised hüpoteesid keskenduvad reageerivate ainete ja katalüsaatori pinna vaheliste sidemete moodustumise olemusele ja seaduspärasustele, olenevalt viimase elektronstruktuurist. On aga ilmne, et katalüsaatori roll on aktiveerida reaktiive – redutseeritud ühendit ja molekulaarset vesinikku.
^
1. Taastamine nikkelkatalüsaatoritel
Raviainete sünteesil kasutatakse laialdaselt nikkelkatalüsaatoreid (Sabatier katalüsaator, Raney nikkel jt) ja niklipõhiseid katalüsaatoreid (vask-nikkel, nikkelkarbonaat jne).
^ AGA) Mittepürofoorse nikli katalüsaator saada : nikkelformiaadi lagunemine parafiinikeskkonnas temperatuuril 250-270°C; taastamine nikkelnitraat vesinik kõrgel temperatuuril ( Sabatier katalüsaator ) ja muud meetodid:
Tegevus nikkelkatalüsaator Sabatier sõltub selle valmistamise temperatuurist. Optimaalne temperatuur 300-320 °C.
Taastumine Sabatieri ja Sendereni meetodil viiakse läbi gaasifaasis, juhtides üle nikli (või läbi katalüsaatorikihi) vesiniku ja redutseeritava aine aurude segu.
^ B) Skeleti katalüsaator Raney nikkel kokkama nikli ja alumiiniumi sulamist, lahustades alumiiniumi leelise vesilahuses aluminaadi kujul (20% leelis temperatuuril 50 °C). Raney Nikkel Sellel on spetsiifiline poorne struktuur Ja sisaldab suur hulk sorbeeritud vesinik Ja nikkelhüdriid. Ta pürofoorne (võimeline õhus isesüttimiseks), seega hoitakse seda veekihi all. Katalüsaatori aktiivsus sõltub valmistamismeetodist (leelise kontsentratsioon, temperatuur, leostumise kestus ja pesemismeetod) ning väheneb katalüsaatori säilitamise ajal.
Taastumine vesiniku juuresolekul Raney nikkel viiakse läbi surve all sisseautoklaavid tavaliselt alkohoolses keskkonnas. Kuna katalüsaatoril on suur tihedus ja see settib kiiresti reaktori põhja, on vajalik heasegamine . Pärast redutseerimise lõppu, mida hinnatakse neeldunud vesiniku koguse järgi, eraldatakse katalüsaator filtrimisega ja alkohol destilleeritakse.
^ C) Nikkelkatalüsaatorid lai kasutada mitmesuguste ühenduste taastamiseks . Taastumissügavus sõltub protsessi tingimustest ja katalüsaatori aktiivsusest. Näiteks nitrobenseeni redutseerimisel vesinikuga Raney nikli juuresolekul rõhul 1 atm. saada aniliini ja 95 atm juures. tsükloheksüülamiin:

Õigesti valitud reaktsioonitingimused ja Raney nikkelkatalüsaatori aktiivsus võimaldavad rakendada järgmisi protsesse:
^ 1. Eraldatud mitmiksidemete taastamine, mõjutamata aromaatset süsteemi ja muid funktsionaalrühmi, viiakse need läbi temperatuuril 10–30 atm ja temperatuuril kuni 50 ° C: need viiakse läbi temperatuuril 150 ± 30°С ja survet üle 70 atm näiteks mentooli sünteesil tümoolist:

Sarnastes tingimustes redutseeritakse püridiini derivaadid:

Vaatamata tugevatele erinevustele redutseerimistingimustes, tuleb märkida, et aromaatseid rõngaid on kõige raskem taastada: 70-100 atm ja temperatuuridel üle 100 ° C. Muud funktsioonid - rõhul kuni 30 atm ja temperatuuril alla 100 ° C.
^ 6. Redutseeriv amiinimine (aldehüüdide ja ketoonide reaktsioon ammoniaagi ja vesinikuga Raney nikli juuresolekul) kasutatakse asaliini, isopropaani, butamiidi, bensamooni, fenamiini jne sünteesil:


Metüülbensüülketooni, 12-15% ammoniaagi vesilahust ja Raney niklit kuumutatakse autoklaavis ning vesinik lastakse läbi 60-65 °C juures 1 tund vähese rõhu all. Seejärel asendatakse vesinik lämmastikuga, katalüsaator filtritakse ammoniaagi vesikihi all välja, filtraat aurustatakse ja saadakse fenamiini tehniline alus. Toote saagis 90-91%.
^
2. Taastamine plaatina- ja pallaadiumkatalüsaatoritel
Plaatina- ja pallaadiumkatalüsaatorid, millel on märkimisväärselt kõik nikli eelised aktiivsem
neid. Vesinik nende juuresolekul taastada peaaegu kõik orgaanilised ühendid
mida on võimalik vähendada, sageli atmosfäärirõhul. Küll aga plaatina ja pallaadiumi katalüsaatorid kallis
ja tänu suurele aktiivsusele on tavalistel katalüsaatoritel
madal selektiivsus
. Katalüsaatorite aktiivsuse muutmiseks ja nende selektiivsuse suurendamiseks mitmesugused lisandid
.
Neid kasutatakse kõige sagedamini nagu plaatina või pallaadium mob või pärast metallide, nende kloriidide ja oksiidide sadestumist meedias - aktiivsüsi, pimsskivi, ränidioksiid, silikageel.
1. Nitrorühm redutseeritakse väga kergesti vesinikuga plaatina või pallaadiummusta juuresolekul. Selle tulemusena moodustuvad amiinid peaaegu kvantitatiivse saagisega. Selle reaktsiooni avastas M.M. Zaitsev (kuulsa A.M. Zaitsevi noorem vend) 1872. Taastamist saab läbi viia nii auru (gaasi) faasis kui ka vedelas faasis.
^ 2. Topelt- või kolmiksidemete taastamine alifaatsetes või alitsüklilistes ühendites toimub palju lihtsam kui areenide redutseerimine. Erinevalt vesinikust vabanemise hetkel katalüütiliselt aktiveeritud vesinik interakteerub kergemini isoleeritud kaksiksidemetega kui konjugeeritud sidemetega. Atsetüleeni seeria ühendid on aktiveeritud vesiniku toime suhtes väga tundlikud. Esiteks redutseeritakse need etüleeni derivaatideks ja seejärel küllastunud ühenditeks.
Kolmiksideme valikuliseks redutseerimiseks kaksiksidemeks Lindlari katalüsaator , mis on pliatsetaadi lisamisega kaltsiumkarbonaadile sadestunud pallaadium. Seda protsessi kasutatakse paljudes keemia- ja farmaatsiatööstuses, sealhulgas E- ja A-vitamiinide tootmisel:


^ 5. Areenide taastamine läheb kõige raskemini .Taastumise lihtsus aromaatsete süsivesinike arv suureneb koos kondenseerunud tsüklite arvu suurenemisega: benseen . Sarnasuse tõttu aromaatsete ja heteroaromaatsed ühendid viimaseid hüdrogeenitakse enam-vähem samal viisil. aga püridiin sel juhul hüdrogeenitakse kergemini kui benseen:

Polütsüklilised ühendid olenevalt katalüsaatori aktiivsusest ja protsessi tingimustest hüdrogeenitakse täielikult või osaliselt. Monotsüklilised ühendid on kõige raskem taastada ja saadakse ainult tooteid täielik taastumine.
Millal viieliikmelised heterotsüklid sageli esineb sõrmuse lõhenemist. Näiteks taandatakse sylvan 5-hüdroksü-2-pentanooniks:

Heterotsükliliste ühendite osalist redutseerimist saab läbi viia katalüsaatoritena vask või kromiidid .
Lisaks pallaadiumi- ja plaatinakatalüsaatoritele on olemas ka odavam nt vaskkromiit, kuid reaktsioonid kulgevad palju raskemates tingimustes. Seega redutseeritakse arüülketoonid 180–250 °C juures hea saagisega alküülbenseenideks. vask-kroom katalüsaator. 110-130°С juures umbes- Ja P-hüdroksübensaldehüüdid redutseeritakse vastavateks kresoolideks ja umbes- Ja P-hüdroksüarüülketoonid hüdrogeenitakse hüdroksüalküülbenseenideks:
2-metüülfuraan (sylvan) saadakse furfuraali ja vesiniku segu juhtimisel temperatuuril 200–250 °C ja normaalrõhul üle peeneks jahvatatud vaskkromiidi kivisöel:

Plaatina- ja pallaadiumkatalüsaatoritel toimuvad sarnased protsessid kergetes tingimustes (40-90°C, 0,1-0,5 MPa).
^
Elektrolüütiline taastumine
See on kõige lootustandvam tööstusliku taastamise meetod. Omades kõiki katalüütilise hüdrogeenimise eeliseid, on elektrolüütiline redutseerimine märkimisväärne Kasu:
1) Vesiniku puudumine tootmises ja sellest tulenevalt on tootmise plahvatus- ja tuleoht järsult vähenenud. 2) Protsess viiakse läbi atmosfäärirõhul – pole vaja autoklaave ja kõiki nendega seotud ohutusmeetmeid.
miinused meetod on selle ebapiisavad teadmised, energiamahukus, mõned tehnilised ja tehnoloogilised raskused ning sellest tulenevate taaskasutustoodete heterogeensus. Vaatamata heale saagikusele, elektrokeemilised meetodid ei kasutata laialdaselt peenorgaanilises sünteesis. Selle põhjuseks on eelkõige eriseadmete seeriatootmise puudumine.
^ Elektrokeemiliselt taastuda C=C sidemed näiteks piperidiini süntees püridiinist (1896 Ahrens), nitroühendid amiinideks (kõiki vaheühendeid on võimalik saada), karboksüülhapped, sealhulgas aldehüüdid, aldehüüdid alkoholidesse jne.


Salitsüülhappe elektrolüüs viiakse läbi poorse kummimembraaniga elektrolüüsiseadmetes, kasutades amalgameeritud vasest pöörlevaid katoode voolutihedusega 1500 A/m 2 ja pöörlemiskiirusel 1800 pööret minutis. Anoodid on valmistatud perfluoritud pliist.
^ Protsesside jaoks elektrolüütiliseks redutseerimiseks on vaja pidevat vooluallikat ja erivarustus . Redutseerimisanumasse asetatakse kaks elektroodi, mis eraldavad poorse diafragma abil katoodiruumi anoodiruumist. Taastamine toimub katoodil . Redutseeritud aine ühtlaseks tarnimiseks katoodile on see vajalik mikser . Kuna orgaanilised ühendid kas ei dissotsieeru või dissotsieeruvad väga nõrgalt, siis elektrolüütidena kasutage anorgaanilisi happeid või leeliseid.
Tingimuste valik
üksikute ühendite regenereerimine (vastav katood, voolutihedus, lahusti, temperatuur, kontsentratsioon, protsessi kestus) toimub tavaliselt empiiriliselt
.
^
Ohutusfunktsioonid taastamisprotsesside ajal
Taaskasutusprotsesside käigus võivad mitut tüüpi toorained ja tooted olla tulekahju, plahvatuse või mürgistuse allikaks.
Ruumides, kus teostatakse restaureerimist leelismetallid Vee kasutamine kütte- ja jahutusvedelikuna on vastuvõetamatu. Tuleb võtta muid meetmeid tagamaks, et vesi ei puutuks leelismetalliga kokku.
tsingi tolm moodustab õhuga plahvatusohtlikke segusid. Seetõttu on soovitav tsingitolm laadida suspensiooni kujul.
Taastumisel väävelleelised seadmete tihendus, millest saab vesiniksulfiidi eralduda, peab olema nii täielik, et ruumis ei oleks H 2 S lõhna.Väävelvesinikmürgistus tekib juba selle kontsentratsioonil õhus 0,15 g / m 3.
Taastusprotsessid vesinik ja metallhüdriidid , eriti kasutamisel pürofoorsed katalüsaatorid on äärmiselt plahvatusohtlikud ja tuleohtlikud. Seetõttu tuleks erilist tähelepanu pöörata tehnoloogia järgimisele, seadmete tihendamisele ja ventilatsiooni efektiivsusele.
Vältimaks plahvatusohtlike gaaside ning tuleohtlike vedelike ja mürgiste gaaside kontsentratsioonide tekkimist hädaolukorras, tuleb ohtlikesse kohtadesse paigaldada automaatsed signaalseadmed, kus on sisse lülitatud avariiventilatsioon või rakendatakse muid ohutusmeetmeid. Tulekustutusmeetmed töökodades peaksid olema suunatud peamiselt tulekahju ja plahvatuse ärahoidmisele, samuti nende esinemise korral nende lokaliseerimisele.
Toiduvalmistamine ja regenereerimine pürofoorsed katalüsaatorid tuleks hoida eraldi ruumis. On vaja tagada, et katalüsaatorosakesi ei paiskuks reaktori seintele, kuna need on kuivatamisel võimelised isesüttima. Kasutatud katalüüsmuundur võib samuti süttida. Seetõttu ei pressita seda filtrile kuivaks ja transporditakse suspensioonina vees või alkoholis. Võimaluse korral tuleks kasutada mittepürofoorseid katalüsaatoreid.
Plahvatusohtlike reaktsioonimasside purustamine toimub lämmastiku või muu inertgaasiga.
Paljud redutseerimisprotsesside substraadid ja reaktsioonisaadused on kahjulikud või mürgised.