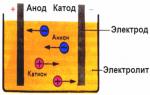
Čo je to proces elektrolýzy. Elektrolyzér
Keď elektrický prúd prechádza roztokom alebo taveninou elektrolytu, na elektródy sa uvoľňujú rozpustené látky alebo iné látky, ktoré sú produktmi sekundárnych reakcií na elektródach. Tento fyzikálno -chemický proces sa nazýva elektrolýza.
Podstata elektrolýzy
V elektrickom poli vytvorenom elektródami sa ióny vo vodivej kvapaline uvádzajú do riadneho pohybu. Negatívna elektróda je katóda, pozitívna je anóda.
Negatívne ióny, nazývané anióny (ióny hydroxylovej skupiny a zvyšky kyselín), sa ponáhľajú na anódu a kladné ióny nazývané katióny (ióny vodíka, kovov, amoniaku atď.)

Redoxný proces prebieha na elektródach: elektrochemická redukcia častíc (atómy, molekuly, katióny) prebieha na katóde a elektrochemická oxidácia častíc (atómy, molekuly, anióny) prebieha na anóde. Disociačné reakcie v elektrolyte sú primárne reakcie a reakcie, ktoré prebiehajú priamo na elektródach, sa nazývajú sekundárne.
Oddelenie reakcií elektrolýzy na primárne a sekundárne pomohlo Michaelovi Faradayovi stanoviť zákony elektrolýzy:
Faradayov prvý elektrolýzny zákon: hmotnosť látky uloženej na elektróde počas elektrolýzy je priamo úmerná množstvu elektriny prenesenej na túto elektródu. Množstvo elektriny sa vzťahuje na elektrický náboj, zvyčajne sa meria v príveskoch.
Faradayov druhý elektrolýzny zákon: pre dané množstvo elektriny (elektrický náboj) je hmotnosť chemického prvku uloženého na elektróde priamo úmerná ekvivalentnej hmotnosti prvku. Ekvivalentná hmotnosť látky je jej molárna hmotnosť delená celým číslom v závislosti od chemickej reakcie, do ktorej je látka zapojená.
![]()
m je hmotnosť látky uloženej na elektróde, Q je celkový elektrický náboj prechádzajúci látkou F = 96 485,33 (83) C mol - 1 je Faradayova konštanta, M je molárna hmotnosť látky (napr. molárna hmotnosť vody H2O = 18 g / mol), z je valenčný počet iónov látky (počet elektrónov na ión).
Všimnite si toho, že M / z je ekvivalentná hmotnosť deponovanej látky. Pre prvý Faradayov zákon sú M, F a z konštanty, takže čím väčšia je hodnota Q, tým väčšia je hodnota m. Pre druhý Faradayov zákon sú Q, F a z konštanty, takže čím väčšia je hodnota M / z (ekvivalentná hmotnosť), tým väčšia je hodnota m.
Elektrolýza je dnes široko používaná v priemysle a technológiách. Napríklad elektrolýza je jednou z najúčinnejších metód priemyselnej výroby vodíka, peroxidu vodíka, oxidu manganičitého, hliníka, sodíka, horčíka, vápnika a ďalších látok. Elektrolýza sa používa na čistenie odpadových vôd, na galvanické pokovovanie, na galvanické pokovovanie a nakoniec na zdroje chemickej energie. Ale najskôr.
Vďaka elektrolýze sa veľa kovov extrahuje z rúd a ďalej sa spracúva. Keď sa teda na rudu alebo koncentrovanú rudu - koncentrát - pôsobia činidlami, kov prejde do roztoku a potom sa kov z roztoku oddelí elektro extrakciou. Čistý kov sa potom vyzráža na katóde. Týmto spôsobom sa získa zinok, meď a kadmium.
Kovy sa podrobia elektrolytickej rafinácii na odstránenie nečistôt a na premenu obsiahnutých nečistôt na formu vhodnú na ďalšie spracovanie. Čistený kov sa odlieva vo forme dosiek a tieto platne sa používajú ako anódy pri elektrolýze.
Keď prúd prechádza, kov anódy sa rozpustí, prechádza vo forme katiónov do roztoku, potom sa katióny vypúšťajú na katóde a tvoria ložisko čistého kovu. Nečistoty anódy sa nerozpúšťajú - vypadávajú ako anódový kal alebo prechádzajú do elektrolytu, odkiaľ sa kontinuálne alebo periodicky odstraňujú.

Zvážte to ako príklad elektrolytická rafinácia medi... Hlavnou zložkou roztoku je síran meďnatý - najbežnejšia a najlacnejšia soľ tohto kovu. Roztok má nízku elektrickú vodivosť. Na zvýšenie je do elektrolytu pridaná kyselina sírová.
Okrem toho sa do roztoku zavádza malé množstvo prísad, čo prispieva k tvorbe kompaktného kovového povlaku. Meď, nikel, olovo, cín, striebro a zlato sa spravidla podrobujú elektrolytickej rafinácii.
Elektrolýza sa používa pri čistení odpadových vôd (elektrokoagulačné, elektroextrakčné a elektroflotačné procesy). Elektrochemická metóda čistenia je jednou z najčastejšie používaných. Na elektrolýzu sa používajú nerozpustné anódy (magnetit, oxid olovnatý, grafit, mangán, ktoré sa ukladajú na titánovom základe) alebo rozpustné (hliník, železo).
Táto metóda sa používa na izoláciu toxických organických a anorganických látok z vody. Medené rúrky sa napríklad odvápňujú roztokom kyseliny sírovej a priemyselné odpadové vody sa potom musia čistiť elektrolýzou s nerozpustnou anódou. Na katóde sa uvoľňuje meď, ktorá sa dá znova použiť v tej istej továrni.
Alkalická odpadová voda sa čistí elektrolýzou, aby sa odstránili kyanidové zlúčeniny. S cieľom urýchliť oxidáciu kyanidov, zvýšiť elektrickú vodivosť a ušetriť energiu sa do vôd aplikuje prísada vo forme chloridu sodného.
Elektrolýza sa vykonáva pomocou grafitovej anódy a oceľovej katódy. Kyanidy sa pri elektrochemickej oxidácii ničia a na anóde sa uvoľňuje chlór. Účinnosť takéhoto čistenia sa blíži 100%.

Okrem priameho elektrochemického čistenia môže byť zahrnutý do procesu elektrolýzy koagulácia... S výnimkou pridávania solí sa elektrolýza vykonáva rozpustnými anódami hliníka alebo železa. Potom sa zničia nielen nečistoty na anóde, ale aj samotná anóda sa rozpustí. Vznikajú aktívne dispergované zlúčeniny, ktoré koagulujú (zahusťujú) koloidné rozptýlené nečistoty.
Táto metóda je účinná pri úprave odpadových vôd z tukov, ropných produktov, farbív, olejov, rádioaktívnych látok atď. Hovorí sa tomu elektrokoagulácia.

Galvanické pokovovanie je elektrolytické ukladanie určitých kovov s cieľom chrániť výrobky pred koróziou a poskytnúť im vhodný estetický dizajn (povlak je vyrobený z chrómu, niklu, striebra, zlata, platiny atď.). Vec sa dôkladne vyčistí, odmastí a použije sa ako katóda v elektrolytickom kúpeli, do ktorého sa naleje soľný roztok kovu, ktorý je potrebné potiahnuť.
Ako anóda sa používa doska z rovnakého kovu. Spravidla sa používa pár anódových dosiek a medzi ne je umiestnený predmet, ktorý má byť galvanicky pokovovaný.
Galvanické pokovovanie - ukladanie kovu na povrch rôznych telies, aby sa reprodukoval ich tvar: formy na odlievanie dielov, sochy, tlačové platne atď.

Galvanické ukladanie kovu na povrch predmetu je možné iba vtedy, ak sú tento povrch alebo celý predmet vodičmi elektrického prúdu; preto je žiaduce používať kovy na výrobu modelov alebo foriem. Na tento účel sú najvhodnejšie kovy s nízkou teplotou topenia: olovo, cín, spájky, zliatina dreva.
Tieto kovy sú mäkké, dobre sa s nimi pracuje so zámočníckymi nástrojmi, dobre sa gravírujú a odlievajú. Po vybudovaní galvanickej vrstvy a dokončení je kov formy roztavený z hotového výrobku.
Dielektrické materiály však stále predstavujú najväčšie príležitosti na výrobu modelov. Na metalizáciu takýchto modelov je potrebné poskytnúť ich povrchovú elektrickú vodivosť. Úspech alebo neúspech v konečnom dôsledku do značnej miery závisí od kvality vodivej vrstvy. Túto vrstvu je možné nanášať jedným z troch spôsobov.
Najbežnejším spôsobom je grafitizácia, je vhodný pre modely vyrobené z plastelínu a iných materiálov, ktoré umožňujú trenie grafitu o povrch.
Ďalší trik je bronzovanie, metóda je dobrá pre modely pomerne zložitých tvarov, pre rôzne materiály, ale vzhľadom na hrúbku bronzovej vrstvy je prenos malých detailov trochu skreslený.
A nakoniec striebrenie, vhodné vo všetkých prípadoch, ale obzvlášť nevyhnutné pre krehké modely s veľmi zložitým tvarom - rastliny, hmyz atď.
Zdroje chemickej energie
Elektrolýza je tiež hlavným procesom, vďaka ktorému fungujú najmodernejšie zdroje chemickej energie, ako sú batérie a akumulátory. V kontakte s elektrolytom sú dve elektródy.
Citrónová batéria (kliknutím na obrázok zväčšíte)

Pôsobenie zdrojov chemického prúdu je založené na priebehu priestorovo oddelených procesov s uzavretým vonkajším obvodom: redukčné činidlo sa oxiduje na zápornej anóde, výsledné voľné elektróny prechádzajú vonkajším obvodom na kladnú katódu a vytvárajú vybíjací prúd, kde sa zúčastňujú redukčnej reakcie oxidantu. Tok záporne nabitých elektrónov vonkajším obvodom teda prechádza z anódy na katódu, to znamená zo zápornej elektródy na kladnú.
Elektrolýza je proces, pri ktorom sa elektrická energia premieňa na chemickú energiu. Tento proces prebieha na elektródach pod vplyvom jednosmerného prúdu. Aké sú produkty elektrolýzy tavenín a roztokov a čo je zahrnuté v koncepte „elektrolýzy“.
Elektrolýza roztavených solí
Elektrolýza je redoxná reakcia, ktorá prebieha na elektródach pri prechode jednosmerného elektrického prúdu roztokom alebo roztaveným elektrolytom.

Ryža. 1. Pojem elektrolýzy.
Chaotický pohyb iónov pôsobením prúdu sa stáva usporiadaným. Anióny sa presúvajú na kladnú elektródu (anódu) a oxidujú na nej, pričom darujú elektróny. Katióny sa presúvajú na negatívny pól (katódu) a sú na ňom redukované, pričom prijímajú elektróny.
Elektródy môžu byť inertné (kovové z platiny alebo zlata alebo nekovové z uhlíka alebo grafitu) alebo aktívne. V tomto prípade sa anóda rozpustí počas procesu elektrolýzy (rozpustná anóda). Je vyrobený z kovov, ako je chróm, nikel, zinok, striebro, meď atď.
Pri elektrolýze roztavených solí, zásad, oxidov a kovových katiónov sa na katóde vypúšťa tvorba jednoduchých látok. Elektrolýza tavenín je priemyselný spôsob výroby kovov, ako je sodík, draslík, vápnik (elektrolýza roztavených solí) a hliníka (elektrolýza roztaveného oxidu hlinitého Al 2 O 3 v kryolite Na 3 AlF 6, ktorý sa používa na uľahčenie prenosu oxidu do taveniny). Schéma elektrolýzy taveniny chloridu sodného NaCl je napríklad nasledovná:
NaCl Na + + Cl -
Katóda(-) (Na +): Na + + e= Na 0
Anóda( -) (Cl -): Cl - - e= Cl 0, 2Cl 0 = Cl 2
Zhrnutý postup:
2Na + + 2Cl- = elektrolýza 2Na + 2Cl2
2NaCl = elektrolýza 2Na + Cl2
Súčasne s výrobou sodíka alkalického kovu sa elektrolýzou soli získava chlór.
Elektrolýza soľných roztokov
Ak sú roztoky soli podrobené elektrolýze, potom spolu s iónmi vytvorenými počas disociácie soli môže byť voda tiež oxidovaná alebo redukovaná na elektródach.
Existuje určitá postupnosť vypúšťania iónov z elektród vo vodných roztokoch.
1. Čím vyšší je štandardný elektródový potenciál kovu, tým ľahšie je ho obnoviť. Inými slovami, čím viac napravo je kov v elektrochemickej sérii napätí, tým ľahšie dôjde k redukcii jeho iónov na katóde. Pri elektrolýze roztokov solí kovov z lítia na hliník vrátane sa molekuly vody na katóde vždy redukujú:
2H20 + 2e = H 2 + 2OH-
Ak sa roztoky solí kovov podrobia elektrolýze, začínajúc od medi a napravo od medi, na katóde sa redukujú iba kovové katióny. Pri elektrolýze solí kovov z mangánu MN na olovnatý Pb je možné redukovať katióny kovov a v niektorých prípadoch aj vodu.
2. Anióny kyslých zvyškov (okrem F-) sa oxidujú na anóde. Ak sa soli kyselín obsahujúcich kyslík podrobia elektrolýze, anióny kyslých zvyškov zostanú v roztoku, voda sa oxiduje:
2H20-4e = 02 + 4H +
3. Ak je anóda rozpustná, dochádza k oxidácii a rozpúšťaniu samotnej anódy:
Príklad: elektrolýza vodného roztoku síranu sodného Na2S04:

Elektrolýzne procesy
Elektrolýza sa stala rozšírenou v metalurgii farebných kovov a v mnohých chemických odvetviach. Kovy ako hliník, zinok, horčík sa získavajú predovšetkým elektrolýzou. Elektrolýza sa okrem toho používa na rafináciu (čistenie) medi, niklu, olova, ako aj na výrobu vodíka, kyslíka, chlóru a mnohých ďalších chemikálií.
Podstatou elektrolýzy je oddelenie častíc látky z elektrolytu pri prúdení jednosmerného prúdu elektrolytickým kúpeľom a ich ukladanie na elektródy ponorené do kúpeľa (elektroextrakcia) alebo pri prenose látok z jednej elektródy cez elektrolyt do druhého (elektrolytická rafinácia). V oboch prípadoch je cieľom procesov získať čo najčistejšie látky, ktoré nie sú kontaminované nečistotami.
Na rozdiel od kovov v elektrolytoch (roztoky solí, kyselín a zásad vo vode a v niektorých ďalších rozpúšťadlách, ako aj v roztavených zlúčeninách) je pozorovaná iónová vodivosť.
Elektrolyty sú vodiče druhej triedy. V týchto roztokoch a taveninách prebieha elektrolytická disociácia - rozpad na kladne a záporne nabité ióny.
Ak sú elektródy pripojené k zdroju elektrickej energie vložené do nádoby s elektrolytom - elektrolyzérom, začne v ňom prúdiť iónový prúd a na katódu sa presunú kladne nabité ióny - katióny (ide predovšetkým o kovy a vodík) a záporne nabité ióny - anióny (chlór, kyslík) - na anódu.
Na anóde sa anióny vzdajú svojho náboja a zmenia sa na neutrálne častice, ktoré sa usadia na elektróde. Na katóde katióny odoberajú elektróny z elektródy a sú tiež neutralizované, usadzujú sa na nich a plyny uvoľnené na elektródach vo forme bublín stúpajú nahor.
Ryža. 1. Procesy počas elektrolýzy. Okruh elektrolytického kúpeľa: 1 - kúpeľ, 2 - elektrolyt, 3 - anóda, 4 - katóda, 5 - napájanie
Elektrický prúd vo vonkajšom obvode je pohyb elektrónov z anódy na katódu (obr. 1). V tomto prípade je roztok vyčerpaný a aby sa zachovala kontinuita procesu elektrolýzy, musí sa obohatiť. Takto sa vykonáva extrakcia určitých látok z elektrolytu (elektroextrakcia).
Ak sa anóda môže rozpustiť v elektrolyte, keď je elektrolyt vyčerpaný, potom jeho častice, rozpúšťajúce sa v elektrolyte, získajú kladný náboj a sú nasmerované na katódu, na ktorej sú uložené, čím prenášajú materiál z anódy na katódu. Pretože sa proces vykonáva tak, že nečistoty obsiahnuté v kove anódy nie sú prenesené na katódu, tento proces sa nazýva elektrolytická rafinácia.
Ak je elektróda umiestnená v roztoku s iónmi tej istej látky, z ktorej je vyrobená, potom pri určitom potenciáli medzi elektródou a roztokom na nej nedôjde k rozpusteniu elektródy ani k depozícii látky z roztoku.
Tento potenciál sa nazýva normálny potenciál látky. Ak je na elektródu aplikovaný negatívnejší potenciál, začne sa na nej uvoľňovať látka (katodický proces), ak je pozitívnejšia, začne sa jej rozpúšťanie (anodický proces).
Hodnota normálnych potenciálov závisí od koncentrácie iónov a teploty. Všeobecne sa uznáva, že normálny potenciál vodíka je považovaný za nulový. Tabuľka 1 ukazuje normálny elektródový potenciál niektorých vodných roztokov látok pri + 25 ° C.
Tabuľka 1. Normálne potenciály elektród pri + 25 ° С
Ak elektrolyt obsahuje ióny rôznych kovov, ióny s nižším negatívnym normálnym potenciálom (meď, striebro, olovo, nikel) sa uvoľňujú najskôr na katóde; kovy alkalických zemín sa izolujú najťažšie. Okrem toho sú vo vodných roztokoch vždy vodíkové ióny, ktoré sa uvoľnia skôr ako všetky kovy s negatívnym normálnym potenciálom, preto sa počas ich elektrolýzy vynakladá značná alebo dokonca väčšina energie na vývoj vodíka .
Špeciálnymi opatreniami je možné v určitých medziach zabrániť vývoju vodíka, kovy s normálnym potenciálom menším ako 1 V (napríklad horčík, hliník, kovy alkalických zemín) však nemožno získať elektrolýzou z vodný roztok. Získavajú sa rozkladom roztavených solí týchto kovov.
Normálne elektródové potenciály látok uvedené v tabuľke. 1, sú minimálne, pri ktorých sa začína proces elektrolýzy, v praxi sú na vývoj procesu nevyhnutné veľké hodnoty potenciálu.
Rozdiel medzi skutočným potenciálom elektródy počas elektrolýzy a potenciálom, ktorý je pre ňu normálny, sa nazýva prepätie. Zvyšuje energetické straty počas elektrolýzy.
Na druhej strane zvýšenie prepätia vodíkových iónov sťažuje jeho uvoľnenie na katóde, čo umožňuje získať elektrolýzou z vodných roztokov množstvo kovov, ktoré sú negatívnejšie ako vodík, ako je olovo, cín, nikel kobalt, chróm a dokonca aj zinok. To sa dosiahne vedením postupu pri zvýšených prúdových hustotách na elektródach, ako aj zavedením určitých látok do elektrolytu.
Priebeh katodických a anodických reakcií počas elektrolýzy je určený nasledujúcimi dvoma Faradayovými zákonmi.
1. Hmota látky uvoľnenej počas elektrolýzy na katóde alebo prechádzajúca z anódy do elektrolytu je úmerná množstvu elektriny prechádzajúcej elektrolytom I τ : m e = α / τ, tu a je elektrochemický ekvivalent látky, g / C.
2. Hmotnosť látky uvoľnenej pri elektrolýze s rovnakým množstvom elektriny je priamo úmerná atómovej hmotnosti látky A a nepriamo úmerná jej valencii n: me = A / 96480n, tu 96480 je Faradayovo číslo, C x mol -1.
Ide teda o elektrochemický ekvivalent látky α = A / 96480n je hmotnosť látky v gramoch, uvoľnená jednotkou množstva elektriny prechádzajúcej elektrolytickým kúpeľom - coulomb (ampérsekunda).
Pre meď A = 63,54, n = 2, α = 63,54 / 96480 -2 = 0,000329 g / C, pre nikel α = 0,000304 g / C, pre zinok α = 0,00034 g / C
V skutočnosti je hmotnosť uvoľnenej látky vždy menšia ako uvedená, čo je vysvetlené radom vedľajších procesov prebiehajúcich v kúpeli (napríklad vývoj vodíka na katóde), únikom prúdu a skratom medzi elektródami .
Pomer hmotnosti skutočne uvoľnenej látky k jej hmotnosti, ktorá sa mala uvoľniť podľa Faradayovho zákona, sa nazýva súčasný výťažok látky η1.
Preto pre skutočný proces m e = η1 NS ( A / 96480n) x It
Prirodzene, vždy η1
Účinnosť prúdu výrazne závisí od prúdovej hustoty na elektróde. So zvýšením prúdovej hustoty na elektróde sa zvyšuje prúdová účinnosť a zvyšuje sa účinnosť procesu.
Napätie U el, ktorý musí byť dodávaný do elektrolyzéra, pozostáva z: rozkladného napätia Ep (potenciálny rozdiel anodických a katodických reakcií), súčtu anodického a katódového prepätia, poklesu napätia v elektrolyte Ep, poklesu napätia v elektrolyt U e = IR ep (R ep je odpor elektrolytu), pokles napätia v pneumatikách, kontaktoch, elektródach U c = I (R w + R až + R e). Získame: U el = Ep + Ep + U e + U c.
Energia spotrebovaná počas elektrolýzy sa rovná: Rel = IU el = I (Ep + Ep + U e + U s)
Z tejto energie sa na uskutočnenie reakcií vynakladá iba prvá zložka, zvyšok sú tepelné straty procesu. Časť tepla uvoľneného v elektrolyte IU e sa využije iba pri elektrolýze roztavených solí, pretože sa spotrebuje na roztavenie solí vložených do elektrolyzéra.
Účinnosť elektrolytického kúpeľa sa dá odhadnúť z hmotnosti látky v gramoch, uvoľnenej na 1 J spotrebovanej elektriny. Táto hodnota sa nazýva energetický výnos látky. Nájdeme ho výrazom q e = (αη1) / U el100, tu α je elektrochemický ekvivalent látky, g / C, η1 je súčasná účinnosť, U email- napätie elektrolytického článku, V.
Elektrolýza
Procesy prebiehajúce počas elektrolýzy sú opačné ako procesy prebiehajúce počas prevádzky galvanického článku. Ak sa počas prevádzky galvanického článku energia spontánne prebiehajúcej redoxnej reakcie premení na elektrickú energiu, potom počas elektrolýzy dôjde k chemickej reakcii v dôsledku energie elektrického prúdu.
Elektrolýza je redoxný proces, ktorý sa vyskytuje na elektródach, keď elektrický prúd prechádza roztokom alebo taveninou elektrolytu.
Elektrolýza sa vykonáva v elektrolyzéroch, ktorých hlavnými zložkami sú dve elektródy ponorené do iónového vodiča (elektrolytu) a pripojené k svorkám zdroja jednosmerného prúdu.
Elektróda pripojená k zápornému pólu zdroja prúdu sa nazýva katóda, a s pozitívom - anóda.
Keď je aplikované napätie, na katóde dochádza k redukčným procesom a na anóde k oxidačným procesom.
Anódy sú nerozpustné (z uhlia, grafitu, platiny a irídia) a rozpustné (z medi, striebra, zinku, kadmia a niklu). Rozpustná anóda prechádza oxidáciou, t.j. posiela elektróny do vonkajšieho obvodu.
Elektrolýza taveniny prebieha podľa nasledujúcej schémy:
1. anióny vznikajúce pri tavení elektrolytu v poradí zvyšovania ich elektródových potenciálov (j 0)
2. katióny sa redukujú na katóde v zostupnom poradí podľa ich j 0.
Napríklad 2NaCl ® 2Na + Cl2K (-) 2Na + + 2e = 2Na 0
tavenina A (+) 2Cl - - 2e = Cl2
Pri určovaní produktov elektrolýzy vodných roztokov elektrolytov je potrebné vziať do úvahy možnosť účasti na redoxných reakciách molekúl vody, z materiálu, z ktorého je anóda vyrobená, povahy iónov a podmienok elektrolýzy.
Tabuľka 3 - Všeobecné pravidlá pre písanie rovníc elektrolýzy
vodné roztoky elektrolytov
1. Elektrolýza roztoku NaCl (inertná anóda)
K (-): Na +; H 2 O
H 2 O + 2e ® H 2 + 2OH -
A (+): Cl-; H 2 O
2 Cl - - 2e ® Cl 2
2H20 + 2NaCl e-mail aktuálne H2 + Cl2 + 2NaOH
Výsledkom je, že Н 2 sa uvoľňuje na katóde, Cl2 na anóde a NaOH sa hromadí v katódovom priestore elektrolyzéra.
2. Elektrolýza roztoku ZnSO 4 (inertná anóda)
K (-): Zn 2+; H 2 O
Zn 2+ + 2е ® Zn 0
2H 2 O + 2e ® H 2 + 2OH -
А ( +): 2H20 - 4e ® 02 + 4H +
Zn 2+ + 4H 2 O ® Zn + H 2 + O 2 + 2OH - + 4H +
Po redukcii molekúl H20 a pridaní iónov SO4 2- na obe strany rovnice získame molekulárnu rovnicu elektrolýzy:
ZnSO 4 + 2H 2O e-mail aktuálne Zn + H 2 + O 2 + H 2 SO 4
3. Elektrolýza roztoku K 2 SO 4 (inertná anóda)
K (-): K +; H 2 O
H 2 O + 2e ® H 2 + 2OH -
A (+): S04 2-; H 2 O
2H20 - 4e ® 02 + 4H +
2H20 + 2e e-mail aktuálne О 2 + 2Н 2
tí. elektrolýza roztoku síranu draselného sa zníži na rozklad vody. Koncentrácia soli v roztoku sa zvyšuje.
4. Elektrolýza roztoku ZnSO 4 zinkovou anódou.
K (-): Zn 2+; H 2 O
Zn 2+ + 2е ® Zn 0
2H 2 O + 2e ® H 2 + 2OH -
A (+): Zn0; H 2 O
Zn 0 -2е ® Zn 2+
Zn 0 + Zn 2+ ® Zn 2+ + Zn 0
Títo. elektrolýza roztoku ZnSO 4 so zinkovou anódou sa redukuje na prenos zinku z anódy na katódu.
Existujú závislosti medzi množstvom látky uvoľnenej na elektródach počas elektrolýzy, množstvom elektriny, ktorá prešla roztokom, a časom elektrolýzy, ktoré sú vyjadrené Faradayovým zákonom.
Faradayov prvý zákon: hmotnosť látky uvoľnenej alebo rozpustenej na elektródach je priamo úmerná množstvu elektriny prechádzajúcej roztokom:
m = ---------; kde m je hmotnosť látky uvoľnenej na elektródach,
FM E je molárna hmotnosť ekvivalentu látky, g / mol,
I - aktuálna sila, A;
t - čas elektrolýzy, sek .;
F - Faradayova konštanta (96500 C / mol).
Faradayov druhý zákon: pre určité množstvo elektriny, ktoré prešlo roztokom, je pomer hmotností zreagovaných látok rovný pomeru molárnych hmotností ich chemických ekvivalentov:
Const
ME 1 ME 2 ME 3
Na izoláciu alebo rozpustenie 1 mol ekvivalentu akejkoľvek látky je potrebné prejsť roztokom alebo roztaviť rovnaké množstvo elektriny, ktoré sa rovná 96 500 Cl. Toto množstvo sa nazýva Faradayova konštanta.
Množstvo látky uvoľnenej na elektróde počas prechodu 1Cl elektriny sa nazýva jej elektrochemický ekvivalent (ε ).
ε = . -------, kde ε-elektrochemický
F ekvivalent
Me - ekvivalent molárnej hmotnosti
prvok (látka); , g / mol
F - Faradayova konštanta, C / mol.
Tabuľka 4 - Elektrochemické ekvivalenty niektorých prvkov
| katión | Ja, g / mol | e, mg | Anión | Ja, g / mol | e, mg |
| Ag+ Al 3+ Au3+ Ba 2+ Ca 2+ Cd 2+ Cr 3+ Cu 2+ Fe 2+ Fe 3+ H+ K+ Li+ Mg 2+ Mn 2+ Na+ Ni 2+ Pb 2+ Sn 2 + Sr 2+ Zn 2+ | 107,88 8,99 65,70 58,70 20,04 56,20 17,34 31,77 27,92 18,61 1,008 39,10 6,94 12,16 27,47 22,90 29,34 103,60 59,40 43,80 32,69 | 1,118 0,93 0,681 0,712 0,208 0,582 0,179 0,329 0,289 0,193 0,0105 0,405 0,072 0,126 0,285 0,238 0,304 1,074 0,616 0,454 0,339 | Br - BrO 3 - Cl - ClO 3 - HCOO - CH 3 COO - CN - CO 3 2- C 2 O 4 2- CrO 4 2- F - I - NO 3 - IO 3 - OH - S 2- SO 4 2 - Se 2- SiO 3 2- | 79,92 127,92 35,46 83,46 45,01 59,02 26,01 30,00 44,50 58,01 19,00 126,42 174,92 62,01 17,00 16,03 48,03 39,50 38,03 | 0,828 1,326 0,368 0,865 0,466 0,612 0,270 0,311 0,456 0,601 0,197 1,315 1,813 0,643 0,177 0,170 0,499 0,411 0,395 |
Oxidačné a redukčné procesy sú jadrom zdrojov chemického prúdu, ako sú batérie.
Akumulátory sú galvanické články, v ktorých sú možné reverzibilné procesy nabíjania a vybíjania, ktoré sa vykonávajú bez pridania látok zapojených do ich práce.
Aby sa obnovila spotrebovaná chemická energia, batéria sa nabíja prechodom prúdu z externého zdroja. V tomto prípade dochádza k elektrochemickým reakciám na elektródach, opačným k tým, ktoré prebehli, keď batéria fungovala ako zdroj prúdu.
V súčasnej dobe sú najbežnejšie olovené akumulátory, v ktorých oxid olovnatý PbO 2 slúži ako kladná elektróda a kovový olovo Pb slúži ako záporná elektróda.
Ako elektrolyt sa používa 25-30% roztok kyseliny sírovej, preto sa olovené batérie nazývajú aj kyslé.
Procesy, ktoré sa vyskytujú počas vybíjania a nabíjania batérie, je možné zhrnúť ako: vybitie
Pb 0 + Pb +4 O 2 + 4Н + + 2SO 4 2- «2Pb 0 + 2SO 4 2- + 2H 2 O
Okrem olovenej batérie sa v praxi používajú alkalické batérie: nikel-kadmium, nikel-železo.
Tabuľka 5 - Typy batérií